Auteurs: Noémie Lavoie, PhD., résidente en biochimie clinique, Nickolas Auclair, PhD., résident en biochimie clinique, Cassandra Goulet, PhD., DEPD, CSPQ, biochimiste clinique, Grappe CN, Site HEJ
Le débit de filtration glomérulaire
Le débit de filtration glomérulaire (DFG) est une mesure de la fonction rénale, reflétant la capacité des reins à filtrer efficacement le sang. Une évaluation précise du DFG revêt une importance clinique majeure, particulièrement dans le contexte de la maladie rénale chronique (MRC) où il est utilisé pour son diagnostic et sa stadification. Aux États-Unis, il est estimé que 37 millions d’adultes sont affectés par la MRC et près de 90% de ces individus demeurent inconscients de leur état, mettant en lumière l’importance du dépistage précoce pour initier des interventions préventives (1).
Le DFG peut être déterminé de deux façons. D’une part, il peut être mesuré (DFGm) grâce à des agents exogènes comme l’inuline ou l’iothalamate. Toutefois, ce processus requiert des ressources importantes et ne peut être intégré dans une pratique clinique de routine. D’autre part, le DFG peut être estimé (DFGe) grâce à différentes équations qui tiennent compte des taux sanguins de créatinine et/ou de cystatine C, ainsi que des variables biologiques telles que le sexe, l’âge et la race (2). La créatinine et la cystatine C sont de bons marqueurs pour l’évaluation de la condition rénale car ce sont des protéines présentes en concentration relativement constante dans le sang et qui sont librement filtrées par le glomérule pour être excrétées dans l’urine (3). La relation entre la créatinine sérique et le DFG est caractérisée par une décroissance exponentielle (Figure 1A). Cette caractéristique est également valable pour la relation entre la cystatine C et le DFG.
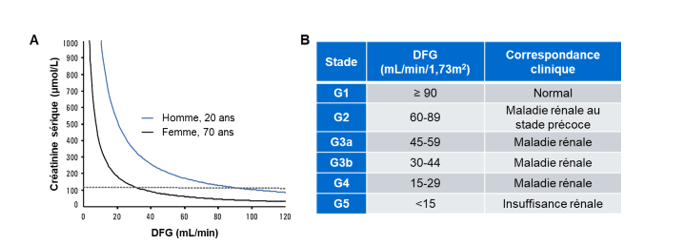
Figure 1. La relation entre la créatinine et le DFG permet la stadification de la maladie rénale. (A) Graphique montrant la relation inversement exponentielle entre la créatinine sérique et le DFG pour un homme âgé de 20 ans pesant 70 kg et une femme âgée de 70 ans pesant 50 kg. La ligne pointillée représente la limite supérieure de l’intervalle de référence de la créatinine sérique. Figure adaptée de Johnson et al. (4). (B) Classement des stades de la MRC en fonction du débit de filtration glomérulaire selon les lignes directrices du Kidney Disease: Improving Global Outcomes (KDIGO).
Chez les adultes, un DFG normal est supérieur à 90 mL/min/1,73m2. Le DFG varie en fonction du sexe et diminue avec l’âge, même chez les personnes sans maladie rénale (Figure 1A). Un DFG de 60 à 89 mL/min/1,73m2 peut indiquer une MRC aux premiers stades, alors qu’un DFG sous 15 mL/min/1,73m2 indique une insuffisance rénale (1). Selon les lignes directrices du Kidney Disease: Improving Global Outcomes (KDIGO), le DFG permet de classer les patients atteints de MRC en cinq catégories (Figure 1B). Ces stades guident les cliniciens dans leurs interventions, comme la prescription de médication pour ralentir la dégénérescence rénale aux stades G2-G3 et l’évaluation pour une greffe rénale au stade G4-G5 (5).
L’évolution des équations pour l’estimation du DFG au fil du temps
Comme la MRC peut être asymptomatique jusqu’aux stades avancés de la maladie, il est essentiel d’avoir des estimations fiables du DFG pour identifier la MRC précocement, particulièrement chez les patients à risque comme les personnes diabétiques, celles âgées de plus de 60 ans, celles souffrant de haute pression et celles ayant un historique familial de MRC (1). Depuis une cinquantaine d’années, divers groupes ont développé des équations pour estimer le DFG avec un maximum de précision en fonction des techniques d’analyse disponibles selon l’époque et en minimisant les interférences dues aux variables démographiques (Tableau 1).
Tableau 1. Résumé des équations utilisées pour évaluer la condition rénale au cours des 50 dernières années.
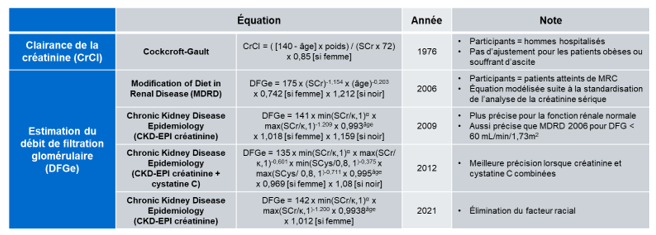
En 1976, Cockcroft et Gault ont développé une première équation pour estimer la clairance de la créatinine avec les données recueillies auprès d’une population de 249 hommes caucasiens hospitalisés âgés de 18 à 92 ans. Cette équation tient compte de la créatinine sérique, de l’âge et du poids corporel. Un facteur d’ajustement est ajouté pour les femmes, étant donné qu’elles ont généralement un taux de créatinine inférieur à celui des hommes en raison de leur masse musculaire plus faible (6). Bien que l’équation de Cockcroft-Gault surestime considérablement le DFG, elle est encore utilisée à ce jour pour l’ajustement des doses de plusieurs médicaments (7).
En 1999, l’étude Modification of Diet in Renal Disease (MDRD) a mesuré l’impact de la diète restrictive en protéines et du contrôle de la pression artérielle sur la progression de l’insuffisance rénale chez 1628 patients aux États-Unis (80,1% de blancs, 12,1% de noirs, 39,6% de femmes). Cette étude a mené au développement d’une équation à six variables pour estimer le DFG (équation non incluse dans le Tableau 1) (8). À cette époque, l’analyse de la créatinine n’était pas standardisée, rendant ainsi la prise en charge des patients plus difficile à cause des variations inter-laboratoires observées pour le DFGe. Suite aux efforts conjoints du National Kidney Disease Education Program (NKDEP) et du College of American Pathologists (CAP) pour implanter la standardisation internationale de la créatinine sérique, une équation à quatre variables a été modélisée en 2006 avec les mêmes données que celles utilisées pour l’équation MDRD 1999 (9). Les équations MDRD incluaient, pour la première fois, un facteur d’ajustement pour la race (population noire ou non-noire). L’ajout de ce facteur était basé, à l’époque, sur le fait que les personnes avec la peau noire ont généralement une masse musculaire plus élevée, ce qui influence à la hausse les niveaux de créatinine sérique (10). La principale limite de l’équation MDRD 2006 est qu’elle sous-estime le DFG lorsque supérieur à 60 mL/min/1,73m2.
Pour pallier les lacunes de l’équation MDRD, le groupe de recherche Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) a mis au point en 2009 une équation basée sur le taux de créatinine sérique aussi précise que l’équation MDRD pour un DFGe inférieur à 60 mL/min/1,73m2 mais plus précise pour des valeurs plus élevées de DFG (11). Le groupe a utilisé 10 études impliquant 8 254 patients d’Amérique du Nord et d’Europe qui ont été randomisés dans un groupe de développement d’équation (n = 5 504, 43% de femmes, 32% de noirs) et un groupe de validation interne (n = 2 750). De plus, 3 896 patients provenant de 16 études ont servi de groupe de validation externe, où seulement 3% des participants étaient noirs. Étant donné que les taux de créatinine sérique sont dépendants de la masse musculaire et du régime alimentaire, le CKD-EPI a publié en 2012 une équation incluant les taux de cystatine C, une protéine moins influencée par ces facteurs (12).
Le DFGe et l’équité médicale
La race est une construction sociale, et non biologique, qui ne tient pas compte de la diversité au sein des différents groupes ethniques, ce qui peut conduire à une iniquité médicale (13,14). Les disparités raciales en regard des déterminants sociaux de la santé ont d’ailleurs été mises en évidence à chaque étape, du diagnostic jusqu’à la prise en charge de la MRC. En effet, la population noire est plus susceptible que la population non-noire de développer une insuffisance rénale chronique, mais est sous-représentée sur les listes d’attente de transplantation rénale et parmi les patients greffés (15). En 2020, des organisations américaines de défense des droits des patients, ainsi qu’un regroupement de professionnels de la santé, se sont associés pour former un groupe de travail visant à remettre en question les pratiques médicales concernant les inégalités sociales dans le domaine de la santé rénale. Le groupe de travail NKF-ASN (National Kidney Foundation et American Society of Nephrology) a entrepris un examen exhaustif de la littérature médicale, ainsi que des témoignages d’experts et de défenseurs des patients, et a conclu que les équations basées sur la race devraient être remplacées (16). Une des raisons de leur conclusion est que la majorité des participants noirs inclus dans le développement de l’équation CKD-EPI 2009 provenait d’une seule étude, l’African American Study of Kidney Disease and Hypertension (AASK), dont certains aspects méthodologiques pourraient impacter l’exactitude de l’équation, notamment, l’âge et la composition corporelle des participants. D’autres hypothèses biologiques ont également été investiguées pour expliquer la différence entre la concentration en créatinine sérique chez la population noire par rapport à la population non-noire comme le taux de conversion de la créatine en créatinine et le niveau de sécrétion tubulaire de créatinine (17).
L’équation CDK-EPI 2021 basée sur les taux de créatinine
En 2021, le groupe de travail CKD-EPI a élaboré une nouvelle équation qui n’intègre plus la notion de race du patient. Cette nouvelle équation a été modélisée avec les données préalablement utilisées pour développer l’équation CKD-EPI 2009 basée sur la créatinine (8254 participants, 32% de noirs), ainsi que les équations CKD-EPI 2012 basée sur la cystatine C et/ou la créatinine (13 études, 5352 participants, 40% de noirs). L’équation CKD-EPI 2021 a ensuite été validée avec une nouvelle cohorte de patients (12 études, 4050 participants, 14% de noirs) (18).
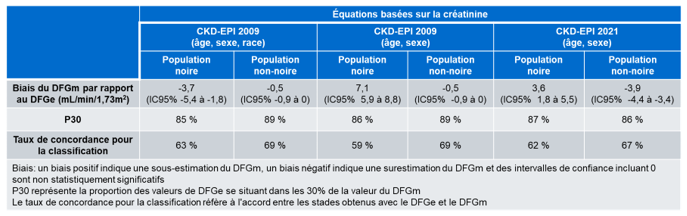
Les auteurs ont comparé les résultats de DFGe obtenus en utilisant les équations basées sur la créatinine CDK-EPI 2009 incluant le facteur de la race, CKD-EPI 2009 sans le facteur de la race et CKD-EPI 2021 par rapport au DFGm (Tableau 2). Les résultats montrent que l’équation CKD-EPI 2009 incluant le facteur de la race surestime le DFG chez la population noire de 3,7 mL/min/1,73m2 et surestime le DFG de 0,5 mL/min/1,73m2 chez la population non-noire. L’utilisation de la CKD-EPI 2009 sans le facteur de race sous-estime le DFG de 7,1 mL/min/1,73m2 chez la population noire et surestime le DFG de 0,5 mL/min/1,73m2 chez la population non-noire. L’équation CKD-EPI 2021, quant à elle, sous-estime le DFG de 3,6 mL/min/1,73m2 et surestime le DFG de 3,9 mL/min/1,73m2 pour les populations noires et non-noires, respectivement. La proportion des valeurs de DFGe se situant dans les 30 % de la valeur du DFGm (P30) est comprise entre 85 et 89 % pour l’ensemble des participants de l’étude peu importe l’équation utilisée. De façon intéressante, le taux de concordance de classification par stade (Figure 1B) chez la population noire est plus bas lorsque le DFG est estimé en supprimant le facteur de race dans l’équation CKD-EPI 2009 (59 % de concordance) par rapport au taux de concordance obtenu avec l’équation CKD-EPI 2009 avec le facteur de race et celui obtenu avec l’équation CKD-EPI 2021 (63 % et 62 % de concordance).
Tableau 2. Résumé de la comparaison des résultats obtenus avec les équations CKD-EPI 2009 avec ou sans le facteur pour la race et CKD-EPI 2021 (équations basées sur la créatinine seulement). Ce tableau résume des données provenant de la figure 1 du l’article publié en 2021 par Inker et son groupe (18).
Les impacts cliniques de l’utilisation de l’équation CKD-EPI 2021
Bien que l’objectif principal de la révision de l’équation CKD-EPI était d’atténuer les disparités raciales chez les patients atteints de MRC, la nouvelle équation CKD-EPI 2021 introduit des biais significatifs pour les deux groupes raciaux. Chez la population noire, le biais passe d’une surestimation de 3,7 mL/min/1,73m2 à une sous-estimation de 3,6 mL/min/1,73m2. Ce changement présente l’avantage potentiel chez ce groupe d’obtenir un diagnostic de MRC et une prise en charge plus précoces, afin de réduire la progression de la MRC. L’attribution d’un DFGe plus faible à la population noire augmente la prévalence estimée de la MRC au sein de celle-ci. D’ailleurs, les travaux de Inker et al. montrent qu’en adoptant l’équation CKD-EPI 2021, la prévalence de MRC chez la population noire augmente de 14,3 % à 16,3 % (18). Néanmoins, ce changement pourrait également conduire à un préjudice potentiel de surdiagnostic de MRC, à des prescriptions de médication inutiles et à l’utilisation inefficace de ressources, entraînant des coûts évitables. Chez la population non-noire, la surestimation du DFG passe de 0,5 mL/min/1,73m2 à 3,9 mL/min/1,73m2. Ainsi, l’attribution d’un DFGe plus élevé à la population non-noire diminue la prévalence estimée de la MRC de 11,7 % à 10,3 % au sein de celle-ci (18). Les conséquences envisageables de ce changement sont un sous-diagnostic de MRC et une baisse du taux d’éligibilité à recevoir des thérapies et à obtenir une consultation en néphrologie. Une analyse supplémentaire des données reliées à la révision de l’équation CKD-EPI a été réalisée par Buchkremer et son groupe (19) et leurs travaux ont mis en évidence deux conclusions principales. D’une part, plus la valeur du DFGe est élevée, plus grand est le biais par rapport au DFGm. D’autre part, le biais a tendance à augmenter avec l’âge chez la population non-noire alors qu’il a tendance à diminuer avec l’âge chez la population noire. Il est essentiel de rappeler que les stades de MRC sont basés sur des seuils arbitraires et que d’autres indicateurs sont à prendre en considération lors de l’évaluation d’un patient, notamment l’albuminurie. À la lumière de ces résultats, les performances légèrement inférieures de l’équation CKD-EPI 2021 pour la population non-noire semble un prix raisonnable à payer pour le gain de la transition d’un biais préjudiciable à un biais favorable chez la population noire.
Le passage de l’équation CKD-EPI 2009 à celle de 2021 apporte une certaine avancée sur le plan social mais un gain mitigé au plan scientifique. D’ailleurs, on peut se questionner sur la capacité de la nouvelle équation à mettre en évidence une MRC non-diagnostiquée chez la population noire. Gutiérrez et al. ont montré que, comparativement à l’équation CKD-EPI 2009, celle de 2021 a atténué les différences raciales dans le risque de l’insuffisance rénale avec thérapie de remplacement et dans le risque de mortalité pour un DFGe normal. Toutefois, presqu’aucune différence raciale significative dans le risque n’est relevée lorsque le DFGe est plus faible (20). Ainsi, près d’un seuil de décision critique, comme celui pour l’adhésion à la greffe rénale, l’impact de l’utilisation de la nouvelle équation est moindre.
La grande majorité des données utilisées pour modéliser les équations CKD-EPI proviennent d’études réalisées aux États-Unis. Ailleurs dans le monde, la proportion d’individus noirs et même les origines de ces individus sont très variables. Plusieurs études européennes ont d’ailleurs mis en évidence les impacts cliniques de l’utilisation de l’équation CKD-EPI 2021.
- La surestimation du DFGe peut atteindre 6 mL/min/1,73m2 chez les européens blancs (21).
- Il y a un reclassement à la baisse pour 34% de la population britannique non-noire au niveau des stades G3 à G5 lorsque l’équation CKD-EPI 2021 remplace l’équation MDRD (22).
- Il y a un reclassement de 15% de la population espagnole, dont 27% en stage G3 à G5 (23).
- La prévalence de la MRC au stade G3a à G5 diminue de 25 %, en particulier chez les personnes de ≥ 65 ans, celles atteintes de diabète et celles souffrant de maladies cardiovasculaires (24).
Le facteur racial dans l’équation CKD-EPI 2009 s’est révélé inapplicable aux populations noires en dehors des États-Unis, comme en Europe, en Afrique et au Brésil. L’utilisation de cette équation sans le facteur de race a démontré de meilleures performances (17,25,26). Par conséquent, puisque l’équation CKD-EPI 2021 performe avec moins de précision que l’équation 2009, en surestimant le DFGe dans la plus grande partie de la population européenne, l’Association Rénale Européenne ainsi que le European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) recommandent de ne pas implanter cette nouvelle équation (27). Ils préconisent plutôt d’attendre de nouveaux développements qui amélioreraient significativement l’estimation du DFG, comme l’ajout de données anthropométriques aux équations d’estimation ou l’utilisation d’analytes autres que la créatinine comme marqueurs de filtration alternatifs.
Comme la distorsion démographique contribue à la sous-performance de l’équation CDK-EPI 2021, nous avons comparé les DFGe obtenus avec l’équation CKD-EPI 2021 avec ceux obtenus avec l’équation utilisée présentement au CHU de Québec (CKD-EPI 2009 sans le facteur de race) pour 1034 patients choisis aléatoirement. Sans connaître la proportion exacte de la population noire dans cet échantillon, les données de Statistique Canada pour l’année 2021 sur l’origine ethnique ou culturelle de la population dans les ménages privés estiment que la ville de Québec compte seulement 3,4 % (18 310/533 540) de résidents s’identifiant à des origines des pays où la population est principalement de couleur noire (28). Les résultats montrent un biais relatif moyen de 4,23 %. Ainsi, 10 % des patients de cet échantillon sont reclassés à la hausse lorsque le DFG est estimé avec l’équation CKD-EPI 2021.
En somme, il ne faut pas oublier que le DFG est la référence ultime en matière de diagnostic de MRC. Le meilleur DFGe, autant pour les populations noires que non-noires, est celui qui estime le plus précisément le DFGm. Or, la nouvelle équation CDK-EPI 2021, en introduisant un biais chez tous les patients (âge, sexe et race confondus), détériore la précision de l’estimation du DFG.
L’équation CDK-EPI 2021 basée sur les taux de créatinine et de cystatine C; une solution potentielle
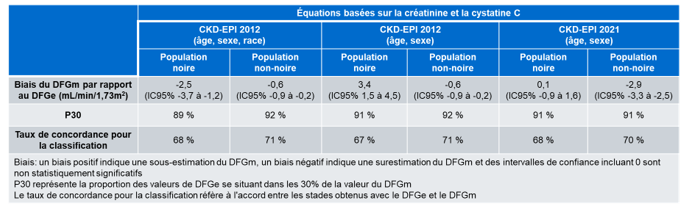
Inker et son groupe ont comparé les résultats de DFGe obtenus en utilisant les équations CKD-EPI 2009 avec et sans le facteur de race ainsi que l’équation CKD-EPI 2021 basées sur les taux de créatinine et de cystatine C (Tableau 3) (18). Il est intéressant de noter que l’équation CKD-EPI 2021 basée sur la créatinine et la cystatine C montre un très faible biais de 0,1 mL/min/1,73m2 pour la population noire et un biais de -2,9 mL/min/1,73m2 pour la population non-noire. La P30 est de 91% pour les deux populations et le taux de concordance est d’environ 70 % pour la classification des stades de la MRC. En comparant ces résultats à ceux obtenus avec toutes les équations étudiées (Tableau 2), il convient de souligner que c’est l’équation CKD-EPI 2021 basée sur les taux de créatinine et de cystatine C qui semble la moins défavorable peu importe le type de population (noire ou non-noire), malgré une certaine surestimation du DFG chez la population non-noire.
Tableau 3. Résumé de la comparaison des résultats obtenus avec les équations CKD-EPI 2012 avec ou sans le facteur pour la race et CKD-EPI 2021 (équations basées sur la créatinine et la cystatine C). Ce tableau résume des données provenant de la figure 1 du l’article publié en 2021 par Inker et son groupe (18).
Une façon d’améliorer l’estimation du DFGe serait d’adopter l’usage de l’équation CKD-EPI 2021 basée sur les taux de créatinine et de cystatine C. Comme la cystatine C est un marqueur de la fonction rénale dont la production est stable et indépendante de la masse musculaire, de l’âge, du sexe et de la race, les équations CKD-EPI basées sur la cystatine C seule ou en combinaison avec la créatinine permettent une estimation plus précise du DFG. D’ailleurs, dans certains cas particuliers où la créatinine ne peut être utilisée (interférences analytiques, profil corporel atypique, sécrétion tubulaire altérée, etc) ou pour une estimation plus précise du DFG dans le cadre d’ajustement de posologie, les lignes directrices KDIGO 2012 recommandent de confirmer le DFGe en utilisant l’équation CDK-EPI basée sur la cystatine C (29). Le dosage de la cystatine C est effectué par néphélométrie ou turbidimétrie et est standardisé depuis 2010 (ERM®-DA471/IFCC). Toutefois, sa disponibilité est restreinte (envois hors Québec) et son coût est relativement élevé par rapport à l’analyse de la créatinine. Ainsi, une meilleure accessibilité à l’analyse de la cystatine C au Québec permettrait une meilleure intégration des lignes directrices dans la pratique clinique et une meilleure prise en charge des patients.
Conclusion
En conclusion, le DFG demeure un élément crucial dans l’évaluation de la fonction rénale, notamment dans le contexte de la MRC. Bien que l’équation CKD-EPI 2021 basée uniquement sur la créatinine montre des biais chez les populations noires et non-noires, l’ajout de la cystatine C améliorerait significativement la précision de l’estimation du DFG. Cette approche pourrait ainsi représenter une solution prometteuse pour une meilleure prise en charge de certains patients, en réduisant les disparités raciales et en améliorant la précision diagnostique et thérapeutique dans la gestion de la MRC.
- https://www.kidney.org/ [Internet]. 2024. National Kidney Foundation.
- Clarke W, Marzinke MA, editors. Contemporary Practice in Clinical Chemistry. 4th ed. AACC Press; 2020.
- Rifai N, Chiu RW, Young I, Burnham CAD, Wittwer CT. Tietz Textbook of Laboratory Medicine. 7th ed. Elsevier; 2023.
- Johnson DW, Usherwood T. Automated reporting of GFR: Coming soon to a laboratory near you! Vol. 34, Australian Family Physician. 2005.
- Chadban SJ, Ahn C, Axelrod DA, Foster BJ, Kasiske BL, Kher V, et al. KDIGO Clinical Practice Guideline on the Evaluation and Management of Candidates for Kidney Transplantation. Transplantation. 2020;104(4).
- Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron. 1976;16(1).
- Fernandez-Prado R, Castillo-Rodriguez E, Velez-Arribas FJ, Gracia-Iguacel C, Ortiz A. Creatinine Clearance Is Not Equal to Glomerular Filtration Rate and Cockcroft-Gault Equation Is Not Equal to CKD-EPI Collaboration Equation. Vol. 129, American Journal of Medicine. 2016.
- Levey AS, Bosch JP, Lewis JB, Greene T, Rogers N, Roth D. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group. Ann Intern Med. 1999;130(6).
- Levey AS, Coresh J, Greene T, Stevens LA, Zhang Y, Hendriksen S, et al. Using standardized serum creatinine values in the modification of diet in renal disease study equation for estimating glomerular filtration rate. Ann Intern Med. 2006;145(4).
- Hsu J, Johansen KL, Hsu CY, Kaysen GA, Chertow GM. Higher serum creatinine concentrations in black patients with chronic kidney disease: Beyond nutritional status and body composition. Clinical Journal of the American Society of Nephrology. 2008;3(4).
- Levey AS, Stevens LA, Schmid CH, Zhang Y (Lucy), Castro AF, Feldman HI, et al. A New Equation to Estimate Glomerular Filtration Rate. Ann Intern Med. 2009 May 5;150(9):604.
- Inker LA, Schmid CH, Tighiouart H, Eckfeldt JH, Feldman HI, Greene T, et al. Estimating Glomerular Filtration Rate from Serum Creatinine and Cystatin C. New England Journal of Medicine. 2012;367(1).
- American Medical Association. New AMA policies recognize race as a social, not biological, construct. 2020.
- Keeys M, Baca J, Maybank A. Race, racism, and the policy of 21st century medicine. Yale Journal of Biology and Medicine. 2021;94(1).
- Buford J, Retzloff S, Wilk AS, McPherson L, Harding JL, Pastan SO, et al. Race, Age, and Kidney Transplant Waitlisting Among Patients Receiving Incident Dialysis in the United States. Kidney Med. 2023;5(10).
- Delgado C, Baweja M, Burrows NR, Crews DC, Eneanya ND, Gadegbeku CA, et al. Reassessing the inclusion of race in diagnosing kidney diseases: An interim report from the NKF-ASN task force. Vol. 32, Journal of the American Society of Nephrology. 2021.
- Delanaye P, Mariat C, Cavalier E, Glassock RJ, Gemenne F, Pottel H. The « race » correction in estimating glomerular filtration rate: an European point of view. Vol. 30, Current Opinion in Nephrology and Hypertension. 2021.
- Inker LA, Eneanya ND, Coresh J, Tighiouart H, Wang D, Sang Y, et al. New Creatinine- and Cystatin C–Based Equations to Estimate GFR without Race. New England Journal of Medicine. 2021;385(19).
- Buchkremer F, Segerer S. The 2009 and 2021 CKD-EPI Equations: A Graphical Analysis of the Effect of Refitting GFR Estimating Equations Without a Race Coefficient. Vol. 4, Kidney Medicine. 2022.
- Gutiérrez OM, Sang Y, Grams ME, Ballew SH, Surapaneni A, Matsushita K, et al. Association of Estimated GFR Calculated Using Race-Free Equations With Kidney Failure and Mortality by Black vs Non-Black Race. JAMA. 2022;327(23).
- Delanaye P, Vidal-Petiot E, Björk J, Ebert N, Eriksen BO, Dubourg L, et al. Performance of creatinine-based equations to estimate glomerular filtration rate in White and Black populations in Europe, Brazil and Africa. Nephrology Dialysis Transplantation. 2023;38(1).
- Sullivan MK, Jani BD, Rutherford E, Welsh P, McConnachie A, Major RW, et al. Potential impact of NICE guidelines on referrals from primary care to nephrology: A primary care database and prospective research study. British Journal of General Practice. 2023;73(727).
- Escribano-Serrano J, Jiménez-Varo E, Escribano-Cobalea M, López-Ceres A, Casto-Jarillo C, Hormigo-Pozo A, et al. Is the use of the new Chronic Kidney Disease Epidemiology Consortium (CKD-EPI 2021) formula appropriate for the Spanish population? Revista Clínica Española (English Edition). 2023;223(3).
- Fu EL, Coresh J, Grams ME, Clase CM, Elinder CG, Paik J, et al. Removing race from the CKD-EPI equation and its impact on prognosis in a predominantly White European population. Nephrology Dialysis Transplantation. 2023;38(1).
- Delanaye P, Pottel H, Glassock RJ. Americentrism in estimation of glomerular filtration rate equations. Vol. 101, Kidney International. 2022.
- Flamant M, Vidal-Petiot E, Metzger M, Haymann JP, Letavernier E, Delatour V, et al. Performance of GFR estimating equations in African Europeans: Basis for a lower race-ethnicity factor than in African Americans. Vol. 62, American Journal of Kidney Diseases. 2013.
- Delanaye P, Schaeffner E, Cozzolino M, Langlois M, Plebani M, Ozben T, et al. The new, race-free, Chronic Kidney Disease Epidemiology Consortium (CKD-EPI) equation to estimate glomerular filtration rate: Is it applicable in Europe? A position statement by the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM). Clin Chem Lab Med. 2023;61(1).
- https://www12.statcan.gc.ca/census-recensement/2021/dp-pd/prof/details/page.cfm?Lang=F&GENDERlist=1,2,3&STATISTIClist=1&HEADERlist=0&DGUIDlist=2021A00052423027&SearchText=quebec [Internet]. 2021. Statistique Canada pour Profil du recensement, Recensement de la population de 2021 de la ville de Québec.
- Levin A, Stevens PE, Bilous RW, Coresh J, De Francisco ALM, De Jong PE, et al. Kidney disease: Improving global outcomes (KDIGO) CKD work group. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Vol. 3, Kidney International Supplements. 2013.

