Auteurs : Maude Bordeleau (PhD, Résidente au DEPD en biochimie clinique), Marie-Claire Bélanger (PhD CSPQ FCACB, Laboratoire regroupé du CHUM, secteur automation), Jean-Maxime Côté (MD MSc FRCPC, Service de néphrologie du CHUM)
L’implication du laboratoire et la prise en charge de l’insuffisance rénale aiguë
L’insuffisance rénale aiguë (IRA) se caractérise par un déclin rapide de la fonction rénale qui peut se développer entre quelques heures et quelques jours [1]. Celle-ci peut se produire de façon fonctionnelle (prérénale) via une hypovolémie ou une hypoperfusion rénale (syndrome cardiorénal ou hépatorénal), de façon obstructive (post-rénal) ou encore suivant des dommages structurels intra-rénaux (dommages tubulaires, glomérulaires ou vasculaires) [2]. La combinaison du tableau clinique du patient, des analyses biomédicales et d’outils d’imagerie rénale guide le diagnostic par le clinicien et lui permet d’adapter le traitement selon la sévérité et l’étiologie de l’IRA. Un délai ou une mauvaise évaluation initiale peut alors entraîner des conséquences graves – développement de morbidités ou mortalité – chez les patients [1,2]. Toutefois, les biomarqueurs sanguins couramment utilisés tels que la créatinine ou l’urée servent surtout à déterminer la présence et la sévérité d’une IRA, alors que la biochimie urinaire (i.e. sodium, albumine, protéine totale, fraction d’excrétion du sodium) comporte d’importantes limitations cliniques réduisant sa pertinence aux atteintes fonctionnelles (prérénales). L’identification de dommages structurels (intra-rénaux) repose généralement sur une myriade d’analyses complémentaires, allant de la microscopie urinaire à la biopsie rénale. Il va sans dire que certaines de ces investigations plus invasives et coûteuses ne sont pas sans risque et sont limitées à des situations exceptionnelles. L’évaluation étiologique et pronostique d’une IRA classique peut alors s’avérer un vrai casse-tête pour le clinicien lorsque le cas du patient est multimorbide, ce qui est assez courant chez les patients hospitalisés à risque de développer une IRA [1].
Au niveau des analyses biomédicales, l’IRA se définit par une élévation de la créatinine – métabolite musculaire de la créatine – de plus de 50% en 7 jours ou de 26.5 mol/L en 48 heures [2,3]. En effet, la clairance de la créatinine, soit la filtration glomérulaire, devient compromise résultant en cette élévation sérique de créatinine. Les critères KDIGO (Kidney Disease : Improving Global Outcomes) servent ensuite à déterminer la sévérité de cette atteinte [3]. Ces stades se divisent en trois niveaux allant d’un état léger (Stade 1) à sévère (Stade 3) qui peut inclure le besoin d’instaurer une thérapie de remplacement rénal (Stade 3d). La prise en charge de l’IRA, incluant le besoin d’une intervention d’urgence tel que la dialyse, la réplétion volémique agressive et des traitements de support, doit donc être adapté au stade et à l’étiologie de celle-ci afin d’optimiser les soins au patient et viser une reprise rapide de la fonction rénale [1,3].
Plusieurs analyses biomédicales sont nécessaires au clinicien pour obtenir un portrait global et juste pour diagnostiquer et suivre l’évolution des épisodes d’IRA, mais malgré ces limitations intrinsèques, la créatinine reste l’analyse pivot de suivi de la fonction rénale. En effet, ces restrictions incluent l’interaction par la diète et de certains médicaments pouvant altérer la sécrétion tubulaire (i.e. trimetroprim, cimetidine) ou encore sa production (i.e. âge, rhabdomyolyse, sarcopénie, amputation) [1]. Il est à noter que, suivant une atteinte rénale (e.g. chirurgie majeure), l’élévation de la créatinine sérique à un niveau compatible avec un diagnostic d’IRA se produit environ 48 heures suivant le dommage [2,3], restreignant sa sensibilité et sa spécificité dans le diagnostic de l’IRA, en plus de n’être d’aucune aide en ce qui a trait à l’évaluation étiologique.
Les «nouveaux» biomarqueurs précoces de l’insuffisance rénale
La recherche de «nouveaux» biomarqueurs non-invasifs de l’insuffisance rénale plus spécifique et plus sensibles à des dommages structurels a débuté au début des années 2000. Dans cet effort de la communauté scientifique, plus d’une centaine de biomarqueurs urinaires et plasmatiques ont été identifiés comme prometteurs pour le diagnostic différentiel, la détection précoce, ainsi que l’établissement du pronostic [4].
Parmi ceux-ci, l’interleukine (IL)-18, KIM-1 (Kidney injury molecule-1), L-FABP (Liver-fatty acid-binding protein), NGAL (Neutrophil gelatinase-associated lipocalin), IGFBP7 (Insulin-like growth factor- binding protein 7) et TIMP-2 (Tissue inhibitor of metalloproteinase 2) ont obtenu le plus d’attention au cours des dernières années [4–10]. L’IL-18, KIM-1, L-FABP et NGAL sont des médiateurs proinflammatoires qui sont rapidement relâchés suivant un dommage tubulaire, alors que IGFBP7 et TIMP-2 sont des régulateurs du cycle cellulaire. Leur performance analytique, incluant leur spécificité et leur sensibilité, est variable selon les populations étudiées.
L’ensemble de ces «nouveaux» biomarqueurs de dommages tubulaires possède des performances analytiques – spécificité et sensibilité – variables selon le contexte clinique, entre ~0.5 et ~0.95 [4,6,8]. Notamment, le moment de collecte du prélèvement urinaire dans le progression de l’IRA en plus de l’état du patient (i.e. type d’intervention subit, comorbidités, infections, etc.) module la performance clinique de ces biomarqueurs. En plus d’aider cliniquement au diagnostic différentiel, certains de ces biomarqueurs ont prouvé leur pertinence pour prédire la survenue d’une IRA avant même la montée de la créatinine ou encore, évaluer la progression et le pronostic une fois l’IRA confirmée (i.e. sévérité, besoin de dialyse et mortalité) [4,8]. IL-18, NGAL et la combinaison du TIMP-2*IGFBP-7, plus particulièrement, semblent offrir jusqu’à présent la meilleure évaluation des risques et des complications [4,8,9]. Ces nouveaux biomarqueurs ont toutefois certaines limitations qui expliquent, en partie, leur intégration tardive en clinique. Par exemple, KIM-1 est également augmenté par la présence d’un carcinome à cellules rénales [6]. NGAL, quant à lui, est aussi sécrété par les neutrophiles activés et peut augmenter de façon non-spécifique en présence d’une infection urinaire ou systémique importante [9,11]. Bien prendre en compte leur performance clinique en plus de leurs limitations intrinsèques est essentiel lorsque vient le temps de les utiliser au chevet des patients.
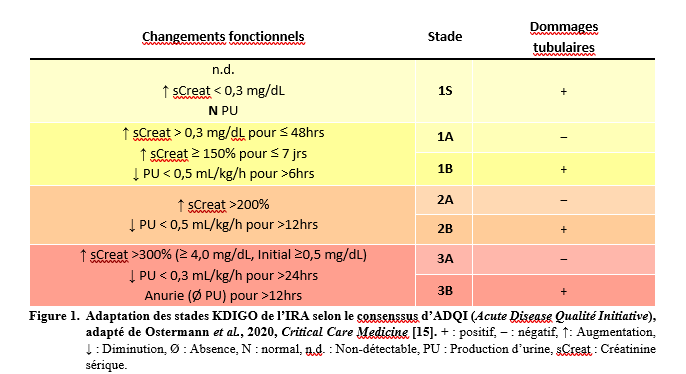
Malgré les nombreuses études de grande envergure confirmant leur performance analytique au sein d’une multitude de populations de patients avec IRA, l’implantation clinique de ces biomarqueurs a tardé à se mettre en place. En effet, malgré les centaines d’études observationnelles de confirmation, la réduction graduelle des coûts des réactifs et leur approbation par de nombreuses agences de santé à travers le monde [12,13], c’est la publication d’études interventionnelles [14] qui a réellement ravivé l’intérêt de la communauté médicale pour leur implantation clinique. D’ailleurs, plusieurs groupes d’experts, dont l’ADQI (Acute Disease Quality Initiative) ont publié un consensus supportant leur utilisation clinique à grande échelle [15]. Basé sur ce nouvel outil permettant enfin de statuer sur la présence de dommages tubulaires, une révision de la classification des épisodes d’IRA a été proposée (Voir Figure 1), puisqu’à un stade similaire d’IRA (basé sur la créatinine), le pronostic et la prise en charge d’un patient diffèrera. Ainsi, un patient avec une IRA de stade 2B présentant des signes de nécrose tubulaire et à risque de progression aura un traitement de support différent de celui avec un stade 2A où l’optimisation de la volémie est à prioriser et où le risque de complication rénale est faible. À l’aube de l’implantation prochaine de ces biomarqueurs, certaines questions surviennent : comment devrait-on les utiliser? Doit-on opter pour un diagnostic précoce, une stratification plus détaillée ou une évaluation du pronostic? Doit-on limiter leur usage à des contextes précis?
Les avancées plus locales du NGAL
Sur ces bases, en 2020, au Centre hospitalier de l’Université de Montréal (CHUM), les Drs Marie-Claire Bélanger, biochimiste clinique, et Jean-Maxime Côté, néphrologue, ont initié les démarches auprès de l’INESSS afin d’ajouter le NGAL pour utilisation clinique au catalogue provincial, une première québécoise [16]. Parmi l’ensemble des biomarqueurs de dommages tubulaires, Dre Bélanger, biochimiste clinique, et Dr Côté ont opté pour le NGAL basé sur la force des évidences qui soutiennent son utilisation, l’intégration possible sur des analyseurs automatisés de même que le coût unitaire moindre. L’ajout de la mesure du NGAL urinaire au bilan traditionnellement prescrit lors d’investigation d’IRA (i.e. sodium urinaire, albumine urinaire, protéine totale urinaire, créatinine et analyse urinaire) permet d’ajouter une information complémentaire sur la présence (ou l’absence) de dommages tubulaires facilitant alors la prise en charge du patient et réduisant possiblement le coût estimé de son traitement [17]. Cet avantage est d’autant plus important lors de l’évaluation de patient ayant un état complexe avec plusieurs comorbidités – communes chez les patients hospitalisés [1,2]. Le NGAL est localement mesuré sur un analyseur automatisé (AU5800, Beckman Coulter©) utilisant un réactif par immunoessai turbidimétrique commercial (NGAL Test™, par BioPorto Diagnostics©). Il peut être analysé sur l’urine et sur le plasma avec un court délai de réponse (analyse possible le jour même). Un audit sur ce projet pilote d’implantation clinique a été réalisé sur les résultats des 250 premiers patients ayant eu une mesure de NGAL, et a permis de confirmer les avantages du NGAL urinaire sur le NGAL plasmatique. D’ailleurs, dorénavant, seul le NGAL urinaire est offert, car il permet une meilleure distinction de l’IRA intra-rénal (p < 0,001 pour le NGAL urinaire vs p = 0.154 pour le NGAL plasmatique évalué par le test non-paramétrique Kruskal-Wallis; Données préliminaires non-publiées, n = 250 patients). De plus,le NGAL urinaire normalisé sur la créatinine offre une performance analytique supérieure (Aire sous la courbe = 0,825; IC 95% 0,766-0,884) au NGAL plasmatique (0,664; IC 95% 0,481-0,847) ainsi qu’aux biomarqueurs classiques de l’IRA tels que la fraction d’excrétion du sodium (0,678; IC 95%0,610-0,747), l’albumine urinaire (0,659; IC 95% 0,585-0,733) et les protéines totales urinaires (0,745; IC 95% 0,681-0,809) selon les mêmes données préliminaires non-publiées recueillies par Dr Côté.
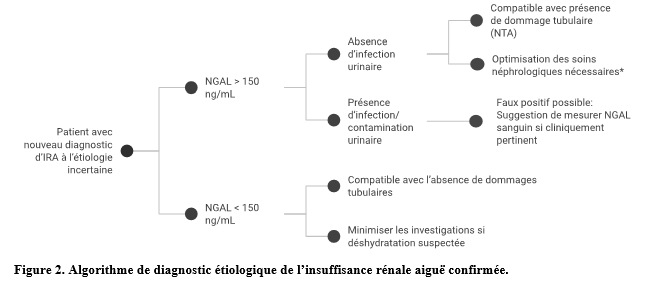
Cette collaboration spéciale entre le secteur de Biochimie du laboratoire regroupé et du Service de néphrologie du CHUM a permis d’offrir le NGAL urinaire et plasmatique en utilisation clinique. Lors de la réunion scientifique du Département de Médecine du CHUM du 17 novembre 2021, Dr Jean-Maxime Côté présentait les premiers résultats préliminaires concernant l’implantation pilote ainsi que l’impact qu’apporterait l’ajout du NGAL lors de la prise en charge de cas complexes d’IRA. L’algorithme de diagnostique étiologique défini à la Figure 2 illustre d’ailleurs les seuils permettant cette distinction, ainsi que les autres facteurs à considérer pour guider une interprétation juste (ex. absence d’infection ou de contamination) et une prise en charge appropriée. L’ajout de l’analyse du NGAL dans l’algorithme de diagnostic de l’IRA est apprécié par la majorité des néphrologues, soit 69% de satisfaction par les cliniciens participant au projet pilote. L’information supplémentaire sur l’étiologie qu’apporte le NGAL a d’ailleurs permis d’entraîner un changement de la prise en charge immédiate dans 42% des cas.
Nouvelle analyse du NGAL et la pandémie
À partir de 2014, l’INESSS a commencé à préconiser l’usage judicieux des analyses biomédicales [18]. Ainsi, il peut parfois sembler difficile d’envisager le développement de nouvelles analyses biomédicales, et ce, d’autant plus avec les pénuries de matières premières et de ressources humaines causées par la pandémie. L’IRA est malheureusement une complication fréquemment observée chez les patients hospitalisés atteints ou non par la COVID-19 [19], ainsi l’optimisation de sa prise en charge demeure un enjeu d’actualité. Dans certains cas d’IRA, l’utilisation judicieuse de biomarqueurs, tel que NGAL, peut permettre de rapidement définir l’étiologie et le pronostic pour adapter les soins des patients afin de réduire leur temps d’hospitalisation et de limiter les risques de morbidités [15], un bénéfice qui serait grandement profitable pour nos hôpitaux.
Pour conclure, même en ces temps difficiles pour le système de soins québécois, des collaborations, telles que celle ayant permis de mettre en place le NGAL au CHUM, permettent de poursuivre l’avancée certaine de la médecine vers une approche individualisée qui passe, sans surprise, par l’utilisation accrue de nouveaux biomarqueurs ainsi que l’implication de l’INESSS et des services de laboratoires de la province. Le NGAL en IRA n’est qu’un des nombreux exemples de la révolution médicale en cours qui nous rapproche de la personnalisation des soins. Présentement seulement disponible pour des fins de recherche, l’équipe du CHUM demeure optimiste de voir prochainement le NGAL s’ajouter au répertoire québécois des analyses de laboratoire.
Références
[1] Bellomo R, Kellum JA, Ronco C. Acute kidney injury. Lancet Lond Engl 2012;380:756–66. [2] 89-1 Insuffisance rénale aiguë (anurie ou oligurie) | Medical Council of Canada n.d. https://mcc.ca/fr/objectifs/expert/ (site consulté le 21 novembre 2021). [3] James M, Bouchard J, Ho J, Klarenbach S, LaFrance J-P, Rigatto C, et al. Canadian Society of Nephrology Commentary on the 2012 KDIGO Clinical Practice Guideline for Acute Kidney Injury. Am J Kidney Dis 2013;61:673–85. [4] Coca SG, Yalavarthy R, Concato J, Parikh CR. Biomarkers for the diagnosis and risk stratification of acute kidney injury: A systematic review. Kidney Int 2008;73:1008–16. [5] The Hunt for a Kidney Troponin | AACC.org n.d. https://www.aacc.org/cln/articles/2020/november/the-hunt-for-a-kidney-troponin (site consulté le 21 novembre 2021). [6] Bonventre JV. Kidney injury molecule-1 (KIM-1): a urinary biomarker and much more. Nephrol Dial Transplant 2009;24:3265–8. [7] Kashani K, Al-Khafaji A, Ardiles T, Artigas A, Bagshaw SM, Bell M, et al. Discovery and validation of cell cycle arrest biomarkers in human acute kidney injury. Crit Care 2013;17:R25. [8] Malhotra R, Siew ED. Biomarkers for the Early Detection and Prognosis of Acute Kidney Injury. Clin J Am Soc Nephrol CJASN 2017;12:149–73. [9] Gomes BC, Silva Júnior JM, Tuon FF. Evaluation of Urinary NGAL as a Diagnostic Tool for Acute Kidney Injury in Critically Ill Patients With Infection: An Original Study. Can J Kidney Health Dis 2020;7:2054358120934215. [10] Parikh CR, Abraham E, Ancukiewicz M, Edelstein CL. Urine IL-18 Is an Early Diagnostic Marker for Acute Kidney Injury and Predicts Mortality in the Intensive Care Unit. J Am Soc Nephrol 2005;16:3046–52. [11] Törnblom S, Nisula S, Petäjä L, Vaara ST, Haapio M, Pesonen E, et al. Urine NGAL as a biomarker for septic AKI: a critical appraisal of clinical utility—data from the observational FINNAKI study. Ann Intensive Care 2020;10:51. [12] Murray PT, Mehta RL, Shaw A, Ronco C, Endre Z, Kellum JA, et al. Potential use of biomarkers in acute kidney injury: report and summary of recommendations from the 10th Acute Dialysis Quality Initiative consensus conference. Kidney Int 2014;85:513–21. [13] Haase-Fielitz A, Haase M, Devarajan P. Neutrophil gelatinase-associated lipocalin as a biomarker of acute kidney injury: a critical evaluation of current status. Ann Clin Biochem 2014;51:335–51. [14] Meersch M, Schmidt C, Hoffmeier A, Van Aken H, Wempe C, Gerss J, et al. Prevention of cardiac surgery-associated AKI by implementing the KDIGO guidelines in high risk patients identified by biomarkers: the PrevAKI randomized controlled trial. Intensive Care Med 2017;43:1551–61. [15] Ostermann M, Zarbock A, Goldstein S, Kashani K, Macedo E, Murugan R, et al. Recommendations on Acute Kidney Injury Biomarkers From the Acute Disease Quality Initiative Consensus Conference: A Consensus Statement. JAMA Netw Open 2020;3:e2019209. [16] Répertoire des procédures suprarégionales de biologie médicale n.d. https://www.msss.gouv.qc.ca/repertoires/biomed/index.php?idsec=0#affichage_sites (site consulté le 21 novembre 2021). [17] Parikh A, Rizzo JA, Canetta P, Forster C, Sise M, Maarouf O, et al. Does NGAL reduce costs? A cost analysis of urine NGAL (uNGAL) & serum creatinine (sCr) for acute kidney injury (AKI) diagnosis. PLoS ONE 2017;12:e0178091. [18] INESSS. INESSS n.d. http://www.inesss.qc.ca/ (site consulté le 21 novembre, 2021). [19] Wan YI, Bien Z, Apea VJ, Orkin CM, Dhairyawan R, Kirwan CJ, et al. Acute kidney injury in COVID-19: multicentre prospective analysis of registry data. Clin Kidney J 2021;14:2356–64.