Auteur : Stéphane Lopes-Paciencia, Ph.D., résident au DEPD en biochimie clinique
Au cours des 30 dernières années, les troponines cardiaques I et T (cTnI et cTnT) se sont établies comme biomarqueurs de référence pour le diagnostic en laboratoire de l’infarctus aigu du myocarde, dû à leurs sensibilités et spécificités très élevées pour les lésions du muscle cardiaque. Leur mesure plasmatique est typiquement réalisée par essais immunoenzymatiques. D’ailleurs, au courant de la dernière décennie, une nouvelle génération d’essais dits à haute sensibilité (hs-cTn) a vu le jour, redéfinissant ainsi les normes dans l’analyse des cTn. En effet, contrairement aux essais des générations antérieures (essais contemporains) qui détectaient les niveaux de cTn dans seulement 20-50% de la population saine, les dernières générations d’essais haute sensibilité arrivent à détecter les cTn dans >95% de la population de référence avec un LOD aussi bas que 1-2 ng/L [1, 2]. Cependant, une telle sensibilité analytique vient nécessairement aux dépens d’une moindre spécificité. Ainsi, en redéfinissant à la baisse les valeurs de référence d’une population saine (dû à l’augmentation de sensibilité), le 99ème percentile URL associé au seuil de positivité pour un essai de cTn est lui aussi abaissé. De ce fait, plusieurs individus préalablement considérés sains auraient dès lors une hs-cTn augmentée [3]. Évidemment, le diagnostic d’un syndrome coronarien aigu (SCA) ne se base pas uniquement sur une valeur seule de cTn. Néanmoins, on constate que cette haute sensibilité vient somme toute brouiller davantage le seuil entre une population saine et malade. Est-ce un mal pour un bien? Que nous apporte cette nouvelle génération d’essais cTn? À la suite de cette lecture, vous serez en mesure de vous faire une idée. Mais d’abord, que font concrètement ces fameuses troponines?
Le mécanisme de contraction musculaire : les troponines en coulisse
Lorsqu’on parle de troponines, il est en fait question d’un complexe hétérotrimétrique formé à partir de trois protéines ayant des fonctions différentes, soit la troponine C (TnC), T (TnT) et I (TnI). Ce complexe fonctionne de concert avec la tropomyosine sur les filaments minces d’actine des cellules musculaires afin de réguler la contraction musculaire. En effet, en réponse à un signal nerveux ayant pour but de déclencher la contraction musculaire, il y a libération du calcium stocké dans le réticulum sarcoplasmique. Ce calcium va alors se lier à la sous-unité TnC, ce qui mène à un changement conformationnel qui déplace la sous-unité inhibitrice TnI du site de liaison de la myosine sur l’actine, le rendant ainsi accessible (Fig. 1). Ce changement conformationnel va par le fait même déplacer la TnT faisant le pont entre la troponine et la tropomyosine enroulée autour de l’actine sur le filament mince. La tête de la myosine pré-activée présente sur le large filament peut alors se lier à son site de liaison sur l’actine (pont d’union). À ce moment, la myosine étant liée à de l’ADP + Pi relâchera le phosphate inorganique (Pi), ce qui va renforcer sa liaison sur l’actine. Par la suite, l’ADP sera relâché à son tour, ce qui va mener à un important changement conformationnel au niveau de la tête de la myosine qui causera un puissant mouvement de traction le long du filament. Une molécule d’ATP viendra alors se lier à la myosine, ce qui mènera à son détachement de l’actine (détachement du pont d’union). L’ATP sera alors hydrolysée en ADP + Pi, ce qui mènera à l’activation de la tête de myosine et à un nouveau cycle de reliaison sur l’actine. Ce mouvement produit par plusieurs têtes de myosines fonctionnant de concert le long du filament d’actine, mènera au rapprochement des filaments minces des deux côtés du sarcomère vers la ligne M au centre de ce dernier. C’est l’ensemble de ces mouvements à l’échelle de plusieurs sarcomères qui sera responsable de la contraction musculaire (Fig. 1). L’ADP relâché pourra alors être rephosphorylé en ATP par la créatine kinase (CK) qui utilise la phosphocréatine comme source de phosphate, puis le processus pourra recommencer.
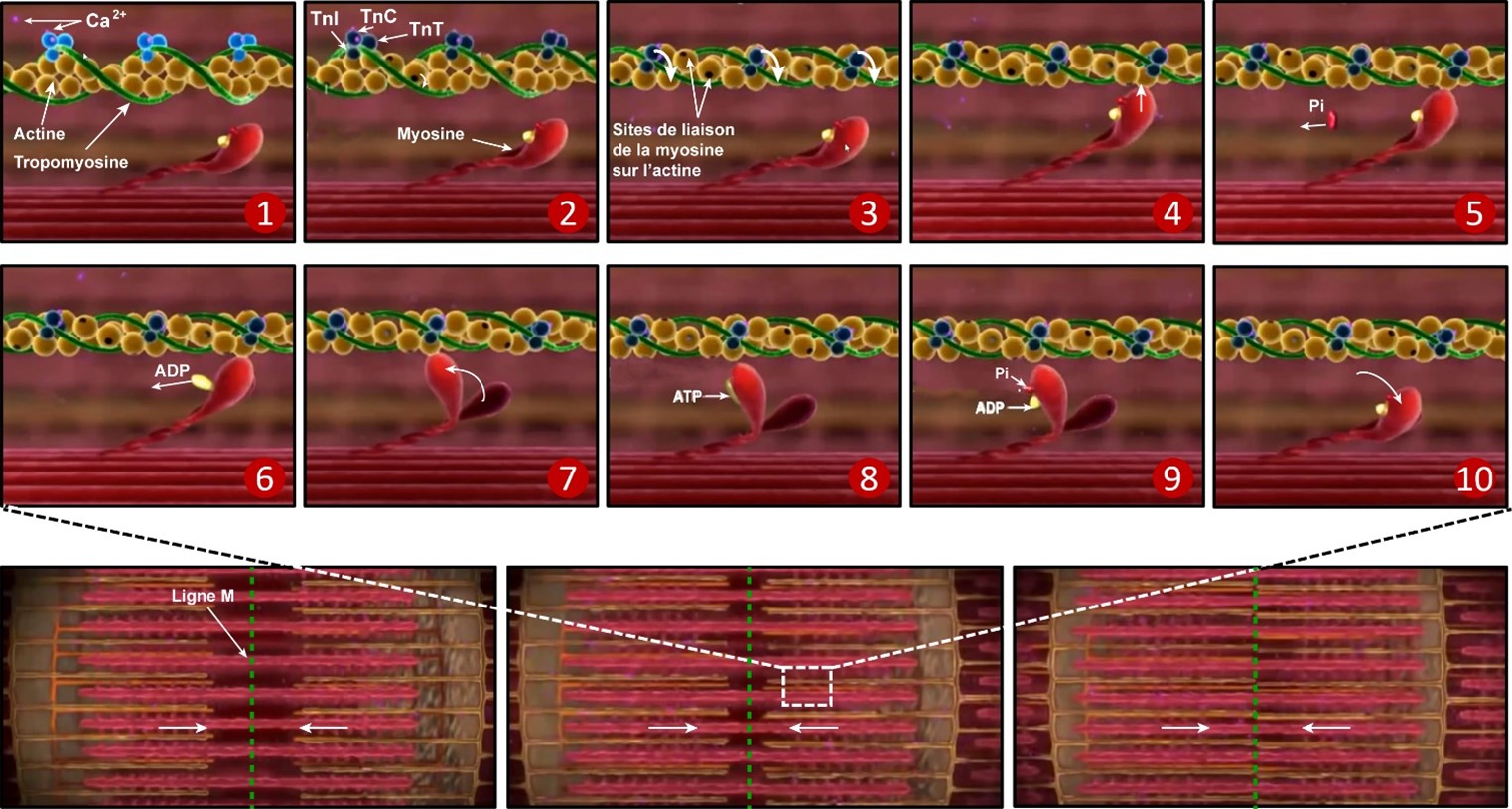
Figure 1. Le complexe troponine dans la contraction musculaire. 1) Liaison du calcium (Ca2+) à la TnC; 2) Changement conformationnel qui déplace la sous-unité inhibitrice TnI du site de liaison de la myosine sur l’actine; 3) Déplacement de la TnT liant la tropomyosine, ce qui induit une rotation de la tropomyosine sur l’actine, exposant les sites de liaison de la myosine sur l’actine; 4) Liaison de la tête de la myosine pré-activée à l’actine (pont d’union); 5) Relâche du phosphate inorganique (Pi) lié à la myosine et renforcement du lien myosine-actine; 6) Relâche de l’ADP liée à la myosine; 7) Changement conformationnel induisant un puissant mouvement de traction vers l’avant; 8) Liaison de l’ATP à la myosine et détachement conséquent de la myosine de sur l’actine (détachement du pont d’union); 9) Hydrolyse de l’ATP et activation de la tête de myosine; 10) Tête de myosine pré-activée et prête pour un nouveau cycle. Figure produite à partir de captures d’écran d’une vidéo de Pearson Education Inc. (2009)
Les troponines spécifiquement associées au muscle cardiaque
Ces trois différentes protéines sont bien évidemment exprimées dans tous les muscles du corps afin de permettre leur contractilité. Cependant, pour chacune de ces trois formes de Tn, il existe différents gènes pouvant eux-mêmes encoder un nombre important d’isoformes. Ainsi, en ce qui concerne la troponine C (TnC), il existe deux gènes, soit la TNNC1 qui encode un type associé aux fibres musculaires lentes et cardiaques, et la TNNC2 qui encode un type associé aux fibres musculaires rapides. D’ailleurs, par fibres musculaires lentes, on entend des fibres associées à des activités nécessitant une endurance prolongée, alors que par fibres musculaires rapides, on entend des fibres associées à des activités nécessitant une force et une puissance maximales sur de courtes périodes. Il faut cependant savoir que la séquence en acides aminés étant très similaire entre ces deux formes, il est impossible de développer des anticorps afin de distinguer la forme cardiaque de la forme squelettique. En ce qui concerne la troponine T (TnT), il existe 3 gènes, soit la TNNT1 associée aux fibres musculaires lentes, la TNNT2 associée au muscle cardiaque et la TNNT3 associée aux fibres musculaires rapides. Contrairement à la TnC, il est possible de développer des anticorps contre la forme cardiaque TNNT2 dû à une séquence suffisamment différente des TNNT1/3. De façon similaire, en ce qui concerne la troponine I (TnI), il existe trois gènes, soit la TNNI1 associée aux fibres musculaires lentes, la TNNI2 associée aux fibres musculaires rapides et la TNNI3 associée au muscle cardiaque. Enfin, tout comme pour la TNNT2, la TNNI3 a une séquence peptidique suffisamment différente des TNNI1/2, ce qui permet encore une fois de développer des anticorps contre la forme cardiaque. Ainsi, au laboratoire clinique, ce sont uniquement les troponines T et I qui sont utilisées comme marqueurs spécifiques des lésions myocardiques.
Il faut savoir que, dans le myocarde, environ 95% des troponines sont sous forme de complexe lié aux protéines contractiles, permettant ainsi la contractilité du muscle cardiaque. Seuls environ 5% des cTnI et cTnT se retrouvent sous forme libre dans le cytoplasme des cardiomyocytes [4, 5]. La fonction précise de cette fraction demeure à ce jour indéterminée. Toutefois, du point de vue du laboratoire, elle permet une détection précoce de plusieurs pathologies associées à des lésions du muscle cardiaque, notamment l’infarctus aigu du myocarde (AMI). En effet, suivant un stress myocardique, il y aura augmentation de la perméabilité de la membrane cellulaire, menant à une libération rapide de cette fraction cytoplasmique de cTnT/I dans la circulation comparativement au complexe troponine dont la dégradation et libération est plus lente [6, 7]. D’ailleurs, plus l’atteinte au myocarde est importante (e.g. atteinte ischémique), plus les niveaux de cTn libérées dans la circulation seront élevés. De ce fait, les cTn sont les marqueurs les plus sensibles et spécifiques d’une lésion myocardique. Ainsi, le dosage quantitatif de cTn fournit également une valeur pronostique qui appuie la stratification du risque et la prise en charge des patients atteints d’un SCA.
La nouvelle génération d’essais haute sensibilité pour les troponines cardiaques
Les essais de cTn ont beaucoup évolué au fil des ans. Il faut savoir que les premières générations d’essais cTn étaient à peine capables de fournir des résultats quantitatifs chez les individus ne présentant pas de lésion myocardique. Puis sont arrivés les essais dits ‘‘contemporains’’ qui arrivaient à détecter les cTn chez 20 à 50 % des individus en bonne santé. Ces essais sont encore déployés dans certains laboratoires à ce jour. Cependant, au cours des dix dernières années, une nouvelle génération d’essais cTn a fait son entrée dans les laboratoires cliniques. Il s’agit des essais à haute-sensibilité (hs), soit les hs-cTnI et hs-cTnT. Ces nouveaux essais sont dits à haute-sensibilité, puisqu’ils répondent aux critères [8] établis par le groupe de travail de la Fédération internationale de chimie clinique (IFCC) sur les applications cliniques des biomarqueurs cardiaques (IFCC TF-CB), aujourd’hui promu au titre de comité (IFCC C-CB). Ces critères sont les suivants :
- Les tests hs-cTn doivent détecter les niveaux de cTn chez au moins 50% des individus en bonne santé;
- L’imprécision totale (CV) au 99ème percentile doit être ≤ 10 %;
- Les résultats doivent être rapportés en ng/L (contrairement aux essais contemporains en ng/mL).
Il est important de mentionner que l’utilisation du 99ème percentile URL (limite supérieure de référence) dans le contexte des cTn est due au manque d’harmonisation entre les différents essais cTn disponibles, ce qui rend impossible l’application d’une seule valeur seuil en tant que seuil physiologique pour une lésion myocardique. En effet, chaque compagnie utilise des anticorps différents ciblant des épitopes également différents sur la cTnI [9]. En ce qui concerne l’essai hs-cTnT, il n’est offert que par Roche, alors ce point n’est pas applicable pour ce dernier. De plus, les divers essais dirigés contre la cTnI utilisent des systèmes ayant des intensités de signaux également différentes (e.g. ester d’acridinium [Abbott], phosphatase alcaline [Beckman], HRP [Ortho], etc.) [9], ce qui ajoute encore à cette variabilité de méthode. Ainsi, il y a un groupe de travail de l’IFCC sur l’harmonisation de la troponine I (IFCC WG-TNI) qui penche actuellement sur le développement de matériaux de référence secondaires qui pourraient être utilisés comme calibrateurs communs aux différentes plateformes (Abbott, Beckman, Roche, Siemens, etc.) [10] afin de pouvoir comparer des résultats entre ces différentes plateformes. Entre-temps, chaque trousse fournit sa propre valeur pour le 99ème percentile qui est basée sur une population régionale de sujets sains. Cependant, puisque plusieurs facteurs tels que le sexe, l’âge et l’ethnie impactent les valeurs de cTn, il est important de vérifier cette valeur auprès d’une population pertinente au site où est implantée la méthode. En ce qui concerne les essais à haute sensibilité, afin d’établir le 99ème percentile, il est recommandé de tester au moins 300 hommes et 300 femmes en bonne santé, avec un mélange approprié d’âges et d’ethnies dans chaque groupe. S’il s’agit simplement d’une vérification de la valeur du 99ème percentile, il est recommandé de tester au moins 20 hommes et 20 femmes selon les mêmes critères.
D’ailleurs, il faut comprendre qu’avec une sensibilité toujours croissante et donc une distribution normale s’étalant de plus en plus vers de basses valeurs de cTn chez les populations saines, la valeur du 99ème percentile a elle aussi continuellement diminué (Fig. 2A). Conséquemment, les essais haute sensibilité (hs) peuvent détecter de manière plus précoce des augmentations de cTn, ce qui permet de minimiser les risques de passer à côté de patients présentant un infarctus aigu du myocarde (AMI). Parallèlement, une telle sensibilité permet également d’appliquer des algorithmes d’exclusion de syndromes coronariens aigus (SCA) plus rapidement [11, 12]. Cependant, cette meilleure sensibilité est également associée à un risque accru de faux-positifs suggestifs d’un SCA. En effet, bien que le risque de manquer des cas d’infarctus du myocarde soit minimisé lors de l’utilisation d’un test hs-cTn, il faut tout de même considérer le fait que les patients âgés sans SCA, ou les patients présentant des comorbidités telles qu’une maladie rénale ou une insuffisance cardiaque, pourraient avoir des niveaux de cTn augmentés. Non seulement ceci, mais la meilleure précision associée aux essais hs (CV au 99ème percentile ≤ 10 %) augmente également la probabilité qu’une différence trouvée entre deux échantillons successifs soit significative et donc indicative d’une lésion myocardique aiguë (Fig. 2B).
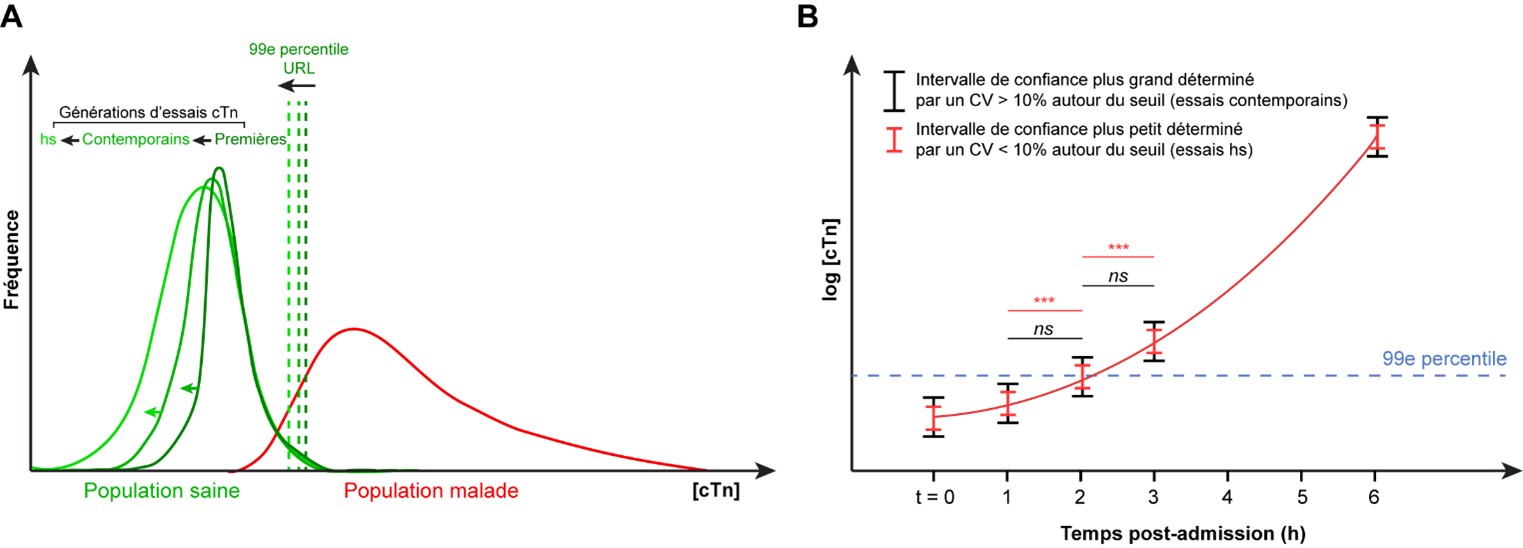
Figure 2. Impact des essais haute sensibilité sur la valeur du 99ème percentile et l’imprécision analytique. (A) Amélioration de la sensibilité analytique des essais de nouvelle génération (hs) pour les cTn et diminution concomitante des valeurs du 99ème percentile. (B) Impact de la diminution du CV à la valeur seuil (99ème percentile) sur la probabilité d’avoir un delta significatif entre deux prélèvements.
Cette augmentation de faux-positifs associée aux essais hs-cTn pourrait donc mener à des suivis diagnostiques inutiles et augmenter le risque de traitements inappropriés, ce que le réseau de la santé essaie d’éviter pour des raisons tant logistiques qu’économiques. Néanmoins, malgré ces préoccupations, le fait est que l’implantation des essais hs pour les cTn permet d’améliorer le diagnostic précoce et l’exclusion sûre de l’infarctus aigu du myocarde, et représente donc un outil essentiel au laboratoire clinique pour l’évaluation diagnostique de patients suspectés de SCA. Aussi, bien que les lésions myocardiques soient un prérequis pour le diagnostic de l’AMI, elles constituent également une condition en soi et ne sont pas nécessairement évocatrices d’un AMI s’il n’y a pas d’indications d’une ischémie. En effet, une lésion myocardique non ischémique peut survenir de manière secondaire à de nombreuses affections cardiaques telles que la myocardite, la péricardite, des cardiomyopathies et l’HTA, ou peut être associée à des affections non cardiaques telles que l’insuffisance rénale [13, 14]. Par conséquent, pour les patients présentant des valeurs de cTn augmentées, les cliniciens doivent distinguer si les patients ont subi une lésion myocardique non ischémique ou l’un des sous-types d’infarctus du myocarde. En absence d’indications d’une ischémie myocardique, un diagnostic de lésion myocardique devrait être posé. Ainsi, selon le document de consensus actuel sur la quatrième définition universelle de l’infarctus du myocarde, ce dernier est diagnostiqué en présence d’une lésion myocardique aiguë mise en évidence par au moins une valeur de cTn au-delà du 99ème percentile, suivie d’une augmentation ou diminution significative des niveaux de troponine cardiaque (delta), le tout en association avec des signes cliniques d’ischémie myocardique, tels que des modifications pathologiques de l’ECG [14]. Évidemment, selon le type d’infarctus du myocarde, les critères précis seront différents.
Subtilités liées aux essais de troponines cardiaques T et I dans le contexte cardiaque
Le développement de méthodes à haute sensibilité pour la cTnT et la cTnI a permis de distinguer les différences analytiques et physiopathologiques entre ces deux marqueurs. Ainsi, au niveau analytique, il faut savoir que l’hémolyse, qui est fréquente dans des échantillons prélevés aux urgences, semble artéfactuellement augmenter les niveaux de cTnI tout en diminuant ceux de cTnT [15], ce qui peut être problématique pour des valeurs autour du 99ème percentile. De plus, les niveaux plasmatiques de hs-cTnT suivent un rythme diurne avec des niveaux qui diminuent au courant de la journée et réaugmentent pour atteindre un pic en matinée (Δ ≈ 4ng/L), ce qui n’est pas le cas de hs-cTnI. Somme toute, ce rythme diurne de hs-cTnT ne semble pas affecter l’exactitude diagnostique de ce marqueur pour l’AMI [16]. Au point de vue pathophysiologique, il faut savoir que la cTnI semble être libérée des cardiomyocytes lésés plus rapidement et en réponse à une lésion moins intense que la cTnT [17], ce qui est associé à une sensibilité accrue. De plus, chez des patients avec des dysfonctions rénales, les niveaux de cTnT sont plus fréquemment élevés que ceux de cTnI, ce qui diminue la spécificité de la cTnT pour le diagnostic de lésions aiguës du myocarde. Ainsi, chez les patients avec une fonction rénale réduite, la cTnI serait l’essai à prioriser [18, 19]. Enfin, il faut savoir que la combinaison de hs-cTnI et hs-cTnT à partir d’un seul prélèvement n’augmente pas la fréquence de détection des patients atteints d’AMI comparé aux marqueurs seuls [20]. Ainsi, hs-cTnI semble être un candidat de choix afin de minimiser les variations circadiennes et les faux-positifs associés aux essais hs-cTnT chez une clientèle ayant des dysfonctions rénales, tout en maximisant la spécificité de l’essai. Le tableau I ci-après donne d’ailleurs un aperçu des paramètres analytiques associés à certains des essais haute sensibilité actuellement approuvés par l’IFCC pour une utilisation en laboratoire clinique et on peut y voir que la spécificité du seul essai hs-cTnT disponible à ce jour (Roche) est moindre que pour les essais hs-cTnI. Toutefois, on constate également que la sensibilité de l’essai hs-cTnT est en général environ 10% supérieure à l’ensemble des essais hs-cTnI. Ainsi, le choix entre un essai hs-cTnI ou hs-cTnT devrait également se faire en fonction de la clientèle du site d’implantation de la méthode. Par exemple, un centre ayant un gros volume d’analyse voudra peut-être prioriser la sensibilité, alors qu’un centre faisant un suivi de patients ayant eu un infarctus voudra peut-être prioriser la spécificité.
Tableau I. Paramètres analytiques au 99ème percentile URL sexe-spécifique à t=0h (baseline) pour les essais haute sensibilité cTn approuvés par l’IFCC. Voir les références [21-27] pour les sources utilisées pour créer ce tableau.
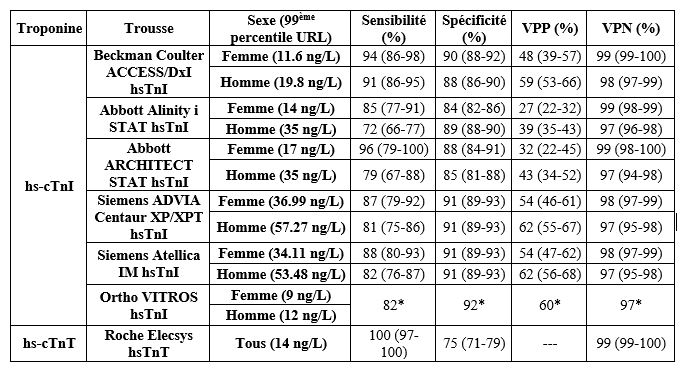
Enfin, il faut mentionner que les paramètres indiqués dans le tableau I sont les paramètres calculés à partir d’un seul prélèvement au temps zéro, soit lors de l’admission des patients aux urgences. Ainsi, suivant les lignes directrices de l’IFCC et l’AHA (American Heart Association) [14], les patients suspectés d’un AMI devraient être prélevés à différents moments afin de pouvoir calculer une valeur de delta tel que mentionné précédemment. D’ailleurs, selon les trousses, cette valeur de delta permet généralement d’augmenter la sensibilité des essais de 5 à 10%. Cela permet donc de pallier, du moins en partie, la différence de sensibilité par rapport à l’essai hs-cTnT. Il est toutefois important de mentionner qu’il existe différents algorithmes permettant de calculer cette valeur de delta pour l’exclusion/inclusion rapide de l’AMI [14]. En effet, il est par exemple possible de faire des prélèvements plus rapprochés (e.g. t = 0h, 1h, 2h, 3h) pour exclure/inclure le diagnostic d’AMI plus rapidement, mais pour cela, il faut s’assurer que l’imprécision de la méthode dans les basses valeurs permette de distinguer adéquatement ces différences. Alternativement, il est possible de faire des mesures plus espacées dans le temps (e.g. t = 0h, 2h, 4h; ou t = 0h, 3h, 6h), ce qui peut faciliter l’obtention de deltas plus significatifs selon l’imprécision de la méthode, mais allonge le temps requis pour exclure/inclure l’AMI. Évidemment, les seuils de deltas considérés comme pathologiques varieront selon l’intervalle d’échantillonnage déterminé. De plus, il faut également considérer le type de clientèle investigué. Par exemple, sachant que les niveaux de cTn augmentent rapidement mais rediminuent très lentement, si un patient se présente tardivement, cela pourrait prendre plus de temps pour qu’une diminution de cTn soit significative versus le temps requis pour inclure l’AMI via une augmentation de cTn chez un patient qui se présente tôt. Ainsi, dans un tel cas, des prélèvements plus espacés seraient plus intéressants. On constate donc que le choix d’algorithme à employer est multifactoriel et devrait nécessairement être discuté entre les différents corps professionnels impliqués, soit les biochimistes, cardiologues et urgentologues afin de s’arrimer à la réalité de la clinique et celle du laboratoire.
Conclusion
En conclusion, les essais dirigés contre les troponines cardiaques ont évolué au fil des années et se sont établis comme outils essentiels dans le diagnostic de l’infarctus aigu du myocarde. Les essais à haute sensibilité ont redéfini les normes avec une meilleure sensibilité et une meilleure précision analytique, offrant ainsi une détection plus précoce des lésions myocardiques. Cette meilleure sensibilité se fit toutefois au détriment d’une spécificité légèrement amoindrie, augmentant ainsi la probabilité de faux-positifs. Conséquemment, des algorithmes plus performants ont vu le jour afin d’incorporer d’autres éléments (e.g. anomalies à l’ECG, deltas, etc.) à la définition universelle d’infarctus du myocarde, permettant de pallier cette moindre spécificité. De ce fait, avec des VPN > 98%, ces essais permettent aujourd’hui d’exclure rapidement des diagnostics d’AMI, contribuant ainsi à une prise en charge rapide des patients. Donc, pour revenir à la question en introduction, l’utilisation des essais hs-cTn dans le contexte des lésions du myocarde est-elle désirable? Certainement! On constate ainsi qu’une réflexion continue sur l’impact clinique et les implications des nouvelles générations d’essais cTn demeure nécessaire afin d’optimiser leur utilisation dans la pratique médicale, notamment en faisant un choix entre un essai hs-cTnT ou hs-cTnI.
Références
- Bhoi, S., et al., High sensitivity troponins and conventional troponins at the bedside. Int J Crit Illn Inj Sci, 2014. 4(3): p. 253-6.
- Chaulin, A., Cardiac Troponins: Contemporary Biological Data and New Methods of Determination. Vasc Health Risk Manag, 2021. 17: p. 299-316.
- Whyte, M.B. and P. Kelly, The normal range: it is not normal and it is not a range. Postgrad Med J, 2018. 94(1117): p. 613-616.
- White, H.D., Pathobiology of troponin elevations: do elevations occur with myocardial ischemia as well as necrosis? J Am Coll Cardiol, 2011. 57(24): p. 2406-8.
- Chenevier-Gobeaux, C., et al., High-sensitivity cardiac troponin assays: answers to frequently asked questions. Arch Cardiovasc Dis, 2015. 108(2): p. 132-49.
- Adams, J.E., 3rd, et al., Cardiac troponin I. A marker with high specificity for cardiac injury. Circulation, 1993. 88(1): p. 101-6.
- Chaulin, A.M., Cardiac Troponins Metabolism: From Biochemical Mechanisms to Clinical Practice (Literature Review). Int J Mol Sci, 2021. 22(20).
- Apple, F.S., et al., IFCC educational materials on selected analytical and clinical applications of high sensitivity cardiac troponin assays. Clin Biochem, 2015. 48(4-5): p. 201-3.
- Apple, F.S., et al., Cardiac Troponin Assays: Guide to Understanding Analytical Characteristics and Their Impact on Clinical Care. Clin Chem, 2017. 63(1): p. 73-81.
- IFCC. Standardisation of Troponin I (WG-TNI). 2023; Available from: https://ifcc.org/ifcc-scientific-division/sd-working-groups/wg-tni/.
- Vasile, V.C. and A.S. Jaffe, High-Sensitivity Cardiac Troponin for the Diagnosis of Patients with Acute Coronary Syndromes. Curr Cardiol Rep, 2017. 19(10): p. 92.
- Fitzgerald, G., R.N. Kerley, and T.J. Kiernan, High-sensitivity troponin assays: development and utility in a modern health-care system. Expert Rev Cardiovasc Ther, 2019. 17(10): p. 763-770.
- Ooi, D.S., P.A. Isotalo, and J.P. Veinot, Correlation of antemortem serum creatine kinase, creatine kinase-MB, troponin I, and troponin T with cardiac pathology. Clin Chem, 2000. 46(3): p. 338-44.
- Thygesen, K., et al., Fourth Universal Definition of Myocardial Infarction (2018). J Am Coll Cardiol, 2018. 72(18): p. 2231-2264.
- Bais, R., The effect of sample hemolysis on cardiac troponin I and T assays. Clin Chem, 2010. 56(8): p. 1357-9.
- Klinkenberg, L.J., et al., Diurnal Rhythm of Cardiac Troponin: Consequences for the Diagnosis of Acute Myocardial Infarction. Clin Chem, 2016. 62(12): p. 1602-1611.
- Rubini Gimenez, M., et al., Direct comparison of high-sensitivity-cardiac troponin I vs. T for the early diagnosis of acute myocardial infarction. Eur Heart J, 2014. 35(34): p. 2303-11.
- Freda, B.J., et al., Cardiac troponins in renal insufficiency: review and clinical implications. J Am Coll Cardiol, 2002. 40(12): p. 2065-71.
- Artunc, F., et al., Sensitive troponins–which suits better for hemodialysis patients? Associated factors and prediction of mortality. PLoS One, 2012. 7(10): p. e47610.
- van der Linden, N., et al., Combining High-Sensitivity Cardiac Troponin I and Cardiac Troponin T in the Early Diagnosis of Acute Myocardial Infarction. Circulation, 2018. 138(10): p. 989-999.
- Coulter, B., ACCESS hsTnI High Sensitivity Troponin I – Instructions For Use – REF B52699. 2023.
- (FDA), D.o.H.a.H.S.-F.a.D.A., Alinity i STAT High Sensitivity Troponin-I – 510(k) Summary – Indications for Use. 2022.
- (FDA), D.o.H.a.H.S.-F.a.D.A., ARCHITECT STAT High Sensitivity Troponin-I – 501(k) Summary – Indications for Use. 2019.
- Siemens, ADVIA Centaur XP/XPT High-Sensitivity Troponin I (TNIH) Datasheet. 2020.
- Siemens, Performance Evaluation of the Atellica IM High-Sensitivity Troponin I Assay – White paper. 2020.
- Ortho-Clinical-Diagnostics. VITROS® High Sensitivity Troponin I Assay from ttps://www2.orthoclinicaldiagnostics.com/emea/diagnostics-library/solutions/high-sensitivity-troponin-assay. *Clinical Performance – Data from clinical trials demonstrates VITROS hs Troponin I test performance in early rule in/out algorithms based on Overall 99th percentile 2019.
- RocheDiagnostics-Cobas, Elecsys Troponin T hs REF 05092744 Datasheet. 2019.

