Auteurs : Nickolas Auclair Ph.D, M.G.P, Cassandra Ringuette-Goulet Ph.D, DEPD, CSPQ et Philippe Desmeules Ph.D, DEPD, CSPQ
Points à retenir
- À partir de 2021, la Société canadienne de cardiologie recommande que les taux de Lp(a) soient testés une fois dans la vie lors du premier bilan lipidique d’un individu, un seuil supérieur à 125 nmol/L nécessite une prise en charge précoce.
- À partir de 2023, le PEER (Patients, Experience, Evidence, Research) ne recommande plus l’analyse de la Lp(a) pour estimer les risques cardiovasculaires.
- La structure de la Lp(a) est très similaire à celle de la LDL, sauf que cette dernière contient également de l’Apo(a), plusieurs domaines de type Kringles ainsi que des phospholipides oxydés.
- Le taux sanguin de Lp(a) chez un individu est principalement expliqué par son profil génétique et aura tendance à rester stable au cours de sa vie.
- Des associations significatives ont été trouvées entre des niveaux sanguins élevés de Lp(a) et le risque de développer des MCV.
- Cependant, aucun lien n’a été démontré entre une diminution des taux sanguins de Lp(a) et une réduction du risque de développer une MCV.
- Il n’existe pas de médicaments sur le marché qui ciblent spécifiquement et réduisent de manière significative les niveaux de Lp(a) dans le sang.
- La présence de nombreuses isoformes d’Apo(a), présentant de 1 à plus de 40 domaines KIV-2, crée des impacts analytiques qui entraînent des variations importantes de la concentration mesurée selon les essais.
Introduction
La prévalence des maladies cardiovasculaires (MCV) est un enjeu particulièrement important pour la société d’aujourd’hui. En effet, ces maladies sont les principales causes d’hospitalisation au Québec, à l’exclusion des accouchements, selon les statistiques de 2013-2014, tout en étant la catégorie de diagnostics dont les coûts directs de santé ont été les plus élevés au Canada au cours de l’année 2008 (1). Bien que ces statistiques aient pu changer ces dernières années en contexte de pandémie, la découverte de nouveaux marqueurs et leur utilisation en clinique pour prédire et contrôler l’apparition des MCV sont toujours d’une grande nécessité. Actuellement, il est recommandé d’utiliser le score de risque de Framingham ou l’âge cardiovasculaire pour évaluer le risque de MCV en prévention primaire, mais d’autres tests complémentaires peuvent être utilisés pour faciliter la prise de décisions cliniques (2).
En 2016, les lignes directrices sur la dyslipidémie de la Société canadienne de cardiologie recommandaient de doser la lipoprotéine (a) (Lp(a)), une petite vésicule composée majoritairement de cholestérol, pour faciliter l’évaluation du risque chez les sujets ayant un score de Framingham intermédiaire ou des antécédents familiaux de maladie coronarienne précoce. Il a été recommandé que les patients dont les seuils sanguins de Lp(a) sont supérieurs à 75 nmol/L fassent l’objet d’une attention particulière, car leur risque de MCV est doublé (3). En 2021, les lignes directrices ont été élargies et recommandent désormais de tester les niveaux de Lp(a) au moins une fois dans le cadre du dépistage initial des lipides chez tous les patients et d’apporter un soutien à la prise en charge précoce des personnes dont les niveaux de Lp(a) sont supérieurs à 125 nmol/L (2).
Étant donné l’engouement qui a été et qui est toujours présent autour de cette lipoprotéine, et considérant les contradictions trouvées entre les différentes lignes directrices, le but de cet article est de fournir une brève vue d’ensemble de la Lp(a). Nous présenterons donc ce qu’est une lipoprotéine, en quoi la Lp(a) diffère des lipoprotéines plus classiques, son rôle dans le développement des maladies cardiovasculaires et les défis analytiques lors de la mesure de sa concentration plasmatique.
Introduction sur la structure et le rôle des lipoprotéines
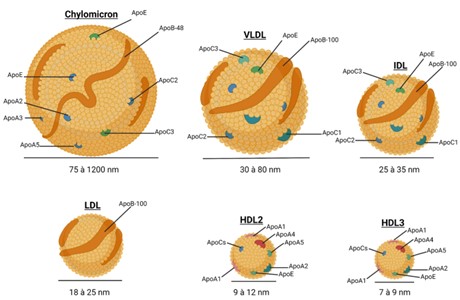
Figure 1 : Taille et composition en protéines des différentes lipoprotéines retrouvées dans la circulation sanguine. Cette illustration a été créée par Auclair, N avec BioRender.com.
Le rôle principal des lipoprotéines est de transporter les lipides dans la circulation sanguine d’un organe à l’autre. Ce sont des vésicules dont le noyau est constitué de lipides estérifiés, entourés d’une monocouche de phospholipides, de cholestérol libre et de protéines appelées apolipoprotéines (Apo). Il existe cinq grandes lipoprotéines sanguines : le chylomicron (CM), la lipoprotéine de très basse densité (VLDL) et sa forme résiduelle appelée lipoprotéine de taille intermédiaire (IDL), la lipoprotéine de basse densité (LDL) et la lipoprotéine de haute densité (HDL), qui peut se présenter sous différentes formes, soit HDL2, soit HDL3. Toutes ces lipoprotéines ont des tailles, des compositions en lipides et en Apo différentes, comme le montre la figure 1 (5).
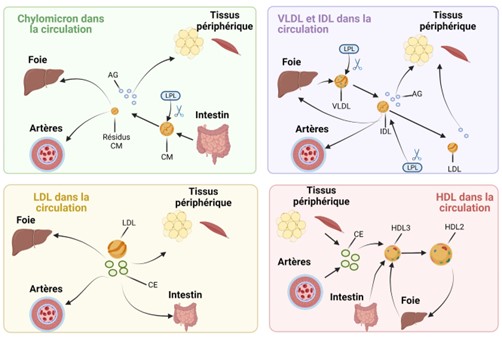
Figure 2 : Destin des différentes lipoprotéines dans la circulation sanguine. Cette illustration a été créée par Auclair, N avec BioRender.com.
Le rôle de chaque lipoprotéine est illustré dans la figure 2. Le CM est produit par l’intestin et transporte les lipides et les vitamines liposolubles de l’alimentation dans la circulation sanguine. Une fois dans la circulation, il est clivé par la lipoprotéine lipase (LPL) qui libère des acides gras libres (AG) de cette lipoprotéine, lesquels se lient à l’albumine et sont alors dirigés vers divers tissus, en particulier les muscles et le tissu adipeux, tandis que le reste du CM est dirigé vers le foie (6). Les VLDL sont sécrétées par le foie et ont le même rôle que les CM. Une fois coupées par la LPL, les VLDL deviennent des IDL, qui sont dirigées vers les tissus périphériques ou coupées à nouveau par la LPL pour libérer davantage d’acides gras dans la circulation sanguine et former les LDL (7). Les LDL sont très riches en cholestérol estérifié (CE) et le transportent vers les tissus périphériques pour réparer certains dommages cellulaires, ou vers le foie pour former des acides biliaires (8). Enfin, les HDL sont principalement produites par le foie et l’intestin pour transporter le cholestérol des tissus périphériques vers le foie pour former les acides biliaires, qui sont sécrétés dans les fèces (9). Ceci est particulièrement important pour prévenir l’accumulation de cholestérol dans les cellules, puisque la plupart d’entre elles sont incapables de le cataboliser (10).
La structure et le rôle de la lipoprotéine (a)
Quelle est la différence entre le rôle de la Lp(a) et les lipoprotéines plus conventionnelles ? En fait, il y a peu à dire sur ces points, car nos connaissances sur la Lp(a) sont encore très limitées. Il a été proposé que la Lp(a) soit synthétisée par les cellules hépatiques et éliminée de la circulation sanguine principalement par le foie, avec une certaine élimination par les reins (11-13). Son rôle physiologique est encore très nébuleux. Certains articles scientifiques suggèrent qu’elle joue un rôle dans la cicatrisation des plaies, la réparation des tissus et la formation des vaisseaux (14-16).
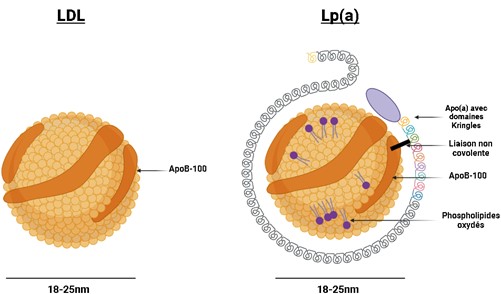
Figure 3 : Différence structurelle entre la Lp(a) et la LDL. Cette illustration a été créée par Auclair, N avec BioRender.com.
Comme le montre la figure 3, sa structure est similaire à celle des LDL, en termes de diamètre et de composition lipidique et protéique. La principale différence avec les LDL est la présence sur cette vésicule d’une seconde protéine appelée Apo(a) (17, 18). Cette Apo(a) a une structure particulière, constituée de boucles appelées « Kringles », auxquelles l’ApoB-100 est liée de façon non covalente. Les Kringles sont également présents dans certains facteurs de coagulation tels que le plasminogène (19). En fait, le gène de l’Apo(a) est très similaire au gène du plasminogène, avec une identité de séquence de 78 à 100 % (20). Dans l’Apo(a), il y a 10 domaines Kringles allant de 1 à 10 (KIV-1 à 10). Le domaine KIV-2 est très important d’un point de vue analytique et sera décrit plus en détail dans une section ultérieure, car on y retrouve de multiple isoformes qui peuvent contenir d’une seule copie à plus de 40 copies de ce domaine, ce qui donne à la protéine une gamme de taille de 300 à 800 kDa (21). De plus, une autre caractéristique de cette vésicule est la présence de phospholipides oxydés à sa surface (22, 23).
La lipoprotéine (a) et les maladies cardiovasculaires
De nombreuses études ont trouvé des associations entre la Lp(a) et le développement de MCV. Elle a été associée à la maladie coronarienne (24), à la valvulopathie aortique calcifiée (25), à l’accident vasculaire cérébral ischémique (26), à l’insuffisance cardiaque (27), à la fibrillation auriculaire (28) et à la maladie artérielle périphérique (29). Une vaste méta-analyse qui a pris en compte 36 cohortes pour un total de 126 634 patients a indiqué qu’il existe des associations hautement significatives entre des concentrations sanguines de Lp(a) supérieures à 30-50 mg/dL (75-125 nmol/L) et le risque de subir un accident vasculaire cérébral ou de développer une maladie coronarienne (30).
Quelques mécanismes ont été proposés pour expliquer ces effets néfastes. Tout d’abord, comme elle a une structure très similaire à celle des LDL, elle peut être retenue dans la paroi artérielle, mais plus facilement que ces dernières. De plus, la Lp(a) possède une grande capacité à recruter des macrophages étant donné sa tendance à l’oxydation de son contenu (31). Cependant, c’est surtout la présence de phospholipides oxydés qui serait la cause principale du développement des MCV, en particulier l’athérosclérose et la valvulopathie aortique calcifiante. Cette présence jouerait un rôle important dans le développement de l’inflammation de la paroi artérielle en augmentant l’adhésion endothéliale des molécules, l’expression des cytokines, l’activation des macrophages et en facilitant la migration des monocytes dans les cultures cellulaires (32-34). Enfin, ces phospholipides oxydés favorisent la progression de la calcification dans les sites vasculaire (35-37).
Contrairement au profil lipoprotéique qui peut être modifié par l’alimentation et l’activité physique, la concentration sanguine de Lp(a) est principalement déterminée par la génétique (30). En effet, le gène de l’Apo(a) est responsable de 91% de la variation de la concentration sanguine de Lp(a) d’un individu, et cette concentration peut varier jusqu’à 1000 fois entre les individus d’une même population (38, 39).
Bien que ces résultats soient très révélateurs, il n’existe actuellement aucun traitement hypolipémiant sur le marché qui cible directement le niveau de Lp(a) dans le sang afin de le réduire. De plus, il n’existe aucune étude clinique démontrant que la réduction de la Lp(a) diminue le risque de développer une MCV. En effet, les études cliniques qui ont abaissé les taux circulants de cette lipoprotéine de 20 à 25 % n’ont pas permis de confirmer cette association (40, 41). Les résultats de ces études ont été jugés peu convaincants, puisqu’elles n’ont pas été menées sur une période suffisamment longue et la réduction de la Lp(a) n’était pas assez importante (42). Au vu de ces résultats, un essai clinique de phase 3 est actuellement en cours pour déterminer si l’utilisation d’un oligonucléotide antisens inhibant la traduction du gène de l’Apo(a) dans les hépatocytes peut atténuer le risque de MCV (NCT04023552). Les essais cliniques précédents avec ces oligonucléotides ont démontré une réduction de 79 à 98 % des niveaux de Lp(a) 60 jours après l’injection, et une réduction de 70 à 80 % 150 jours après l’injection des concentrations les plus élevées (40).
Dosage de la Lp(a) au laboratoire
Outre le fait qu’il n’y a pas d’association entre une diminution de la Lp(a) et une amélioration du risque de développer une MCV, cette vésicule présente des défis analytiques majeurs en laboratoire. En effet, ces défis sont causés par la grande variation des isoformes d’Apo(a) que l’on trouve chez les individus. Comme indiqué précédemment, ces isoformes peuvent posséder d’un seul domaine KIV-2 à plus d’une quarantaine, ce qui fait que l’Apo(a) peut être constituée jusqu’à 70 % de ce domaine (43). Par conséquent, lorsqu’un anticorps polyclonal cible la région KIV-2, il peut reconnaître une molécule d’Apo(a) plus d’une fois, ce qui modifie radicalement le résultat. Par exemple, une personne ayant une isoforme d’Apo(a) avec peu de domaines KIV-2 peut avoir des concentrations sous-estimées, alors qu’une personne ayant une isoforme avec beaucoup de domaines KIV-2 peut avoir des résultats surestimés (voir figure 4) (44). En raison de la présence de ces isoformes et de tous les différents types d’immunodosage actuellement sur le marché, la variation entre les méthodes peut atteindre un facteur 2, avec des CV inter-méthodes de 16 % à 32 % (45).
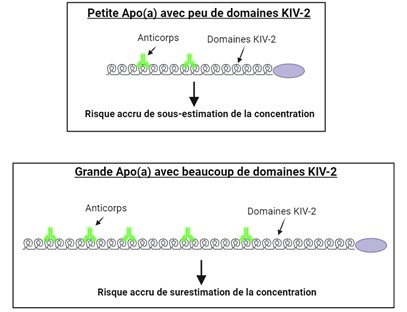
Figure 4 : Différences analytiques entre une isoforme d’Apo(a) avec peu de domaines KIV-2 et une isoforme d’Apo(a) avec beaucoup de domaines KIV-2. Cette illustration a été créée par Auclair, N avec Biorender.com et s’inspire de Kronenberg, 2022 (44).
Il ne faut pas oublier l’importance d’avoir le bon calibrateur. S’il vise un seul domaine, il n’y a pas de problème, mais s’il vise le domaine répétitif KIV-2, cela peut altérer le résultat. En effet, si un seul type de calibrateur est utilisé, par exemple un calibrateur avec 30 KIV-2, il peut sous-estimer les résultats des individus avec de petites isoformes par rapport à un calibrateur avec 21 KIV-2 (44). Par conséquent, la plupart des fournisseurs utilisent maintenant des calibrateurs avec différentes isoformes d’Apo(a). De plus, la dilution d’un échantillon trop concentré peut affecter le résultat, puisque l’échantillon, après dilution, aura tendance à correspondre au calibrateur avec de nombreux domaines, alors que le patient possède de petites isoformes. En fait, des correspondances sont établies entre les concentrations de Lp(a) dans les échantillons et le type de calibrateur puisque les échantillons avec des concentrations élevées sont susceptibles d’avoir des isoformes avec peu de domaines KIV-2, alors que les échantillons avec des concentrations faibles sont plutôt caractérisés par des isoformes avec beaucoup de domaines KIV-2 (44).
L’utilisation de la bonne unité de mesure pour la Lp(a) est un sujet qu’il faut absolument mentionner. Dans le bilan lipidique, la plupart des mesures sont en mg/dL, mais pour la Lp(a), dont les anticorps ne ciblent que l’Apo(a), l’utilisation de cette mesure peut entraîner des erreurs car sa masse varie d’une personne à l’autre. Il est donc préférable de donner la mesure en nmol/L. De plus, si l’on ne connaît pas les isoformes présentes chez un patient, il n’est pas correct de convertir les résultats de nmol/L en mg/dL ou vice versa, car les facteurs de conversion changent d’une isoforme à l’autre. Ce type de conversion doit donc être abandonné (46).
Actuellement, la majorité des tests à haut débit utilisent l’immunoturbidimétrie ou l’immunonéphélémétrie et ont de bonnes reproductibilités, mais utilisent des anticorps polyclonaux qui reconnaissent les domaines KIV-2 (46). Il n’existe actuellement aucun test sur le marché insensible aux isoformes de l’Apo(a), et le test le plus proche est un test japonais Denka-Seiken utilisant 5 calibrateurs différents indépendants les uns des autres, avec différents isoformes de l’Apo(a), traçable en nmol/L (47). Par conséquent, de nombreux types de tests insensibles aux isoformes de l’Apo(a), tels que les tests ELISA basés sur des systèmes de mesure de référence, les tests ciblant l’ApoB-100 ou les analyses LC-MS/MS, sont actuellement en cours de développement (48).
Conclusion
En conclusion, compte tenu de l’abondante littérature scientifique sur la Lp(a), il est tout à fait compréhensible que la Société canadienne de cardiologie recommande que ce test soit réalisé une fois dans le cadre du bilan lipidique initial. Cependant, il est vrai que la Lp(a) est un facteur de risque difficile à interpréter et à utiliser, ce qui explique probablement la décision de PEER de ne plus recommander ce test. En effet, il s’agit d’un facteur presque entièrement génétique pour lequel il n’existe actuellement aucun moyen commercialisé de réduire significativement les taux sanguins. En outre, aucune étude clinique ne vient étayer la relation entre le risque de MCV et la réduction des taux sanguins de Lp(a). Par ailleurs, l’utilisation d’anticorps polyclonaux ciblant les domaines KIV-2 entraîne des variations analytiques qui se traduisent par des changements significatifs dans la concentration mesurée en fonction de l’essai. L’apparition d’oligonucléotides antisens efficaces inhibant la production d’Apo(a) et le développement de nouveaux tests insensibles aux isoformes d’Apo(a) devraient nous aider à mieux démontrer les avantages cliniques de l’analyse de la Lp(a) en laboratoire.
Références
- David B, Yann D, François L-A, Pierre-Carl M. Réduction des maladies cardiovasculaires et dépenses de santé au Québec à l’horizon 2050. CIRANO; 2016 Feb.
- Pearson GJ, Thanassoulis G, Anderson TJ, Barry AR, Couture P, Dayan N, et al. 2021 Canadian Cardiovascular Society Guidelines for the Management of Dyslipidemia for the Prevention of Cardiovascular Disease in Adults. Can J Cardiol. 2021;37(8):1129-50.
- Anderson TJ, Gregoire J, Pearson GJ, Barry AR, Couture P, Dawes M, et al. 2016 Canadian Cardiovascular Society Guidelines for the Management of Dyslipidemia for the Prevention of Cardiovascular Disease in the Adult. Can J Cardiol. 2016;32(11):1263-82.
- Kolber MR, Klarenbach S, Cauchon M, Cotterill M, Regier L, Marceau RD, et al. PEER simplified lipid guideline 2023 update: Prevention and management of cardiovascular disease in primary care. Can Fam Physician. 2023;69(10):675-86.
- Feingold KR. Introduction to Lipids and Lipoproteins. In: Feingold KR, Anawalt B, Boyce A, Chrousos G, de Herder WW, Dhatariya K, et al., editors. Endotext. South Dartmouth (MA)2000.
- Wood P, Imaichi K, Knowles J, Michaels G, Kinsell L. The Lipid Composition of Human Plasma Chylomicrons. J Lipid Res. 1964;5:225-31.
- Huang JK, Lee HC. Emerging Evidence of Pathological Roles of Very-Low-Density Lipoprotein (VLDL). Int J Mol Sci. 2022;23(8).
- Goldstein JL, Brown MS. The LDL receptor. Arterioscler Thromb Vasc Biol. 2009;29(4):431-8.
- Zhou L, Li C, Gao L, Wang A. High-density lipoprotein synthesis and metabolism (Review). Mol Med Rep. 2015;12(3):4015-21.
- Rosenson RS, Brewer HB, Jr., Davidson WS, Fayad ZA, Fuster V, Goldstein J, et al. Cholesterol efflux and atheroprotection: advancing the concept of reverse cholesterol transport. Circulation. 2012;125(15):1905-19.
- Kraft HG, Menzel HJ, Hoppichler F, Vogel W, Utermann G. Changes of genetic apolipoprotein phenotypes caused by liver transplantation. Implications for apolipoprotein synthesis. J Clin Invest. 1989;83(1):137-42.
- Hrzenjak A, Frank S, Wo X, Zhou Y, Van Berkel T, Kostner GM. Galactose-specific asialoglycoprotein receptor is involved in lipoprotein (a) catabolism. Biochem J. 2003;376(Pt 3):765-71.
- Cain WJ, Millar JS, Himebauch AS, Tietge UJ, Maugeais C, Usher D, et al. Lipoprotein [a] is cleared from the plasma primarily by the liver in a process mediated by apolipoprotein [a]. J Lipid Res. 2005;46(12):2681-91.
- Lippi G, Guidi G. Lipoprotein(a): from ancestral benefit to modern pathogen? QJM. 2000;93(2):75-84.
- Leischik R, Dworrak B. [Lipoprotein(a): importance for the fibrinolytic system and thromboembolic complications]. Herz. 2006;31(2):144-52.
- Pamir N, Fazio S. Lipoprotein(a) Gets Worse. Circ Res. 2020;126(10):1360-2.
- Berg K. A New Serum Type System in Man–the Lp System. Acta Pathol Microbiol Scand. 1963;59:369-82.
- Maranhao RC, Carvalho PO, Strunz CC, Pileggi F. Lipoprotein (a): structure, pathophysiology and clinical implications. Arq Bras Cardiol. 2014;103(1):76-84.
- Eaton DL, Fless GM, Kohr WJ, McLean JW, Xu QT, Miller CG, et al. Partial amino acid sequence of apolipoprotein(a) shows that it is homologous to plasminogen. Proc Natl Acad Sci U S A. 1987;84(10):3224-8.
- McLean JW, Tomlinson JE, Kuang WJ, Eaton DL, Chen EY, Fless GM, et al. cDNA sequence of human apolipoprotein(a) is homologous to plasminogen. Nature. 1987;330(6144):132-7.
- Schmidt K, Noureen A, Kronenberg F, Utermann G. Structure, function, and genetics of lipoprotein (a). J Lipid Res. 2016;57(8):1339-59.
- Tsimikas S. A Test in Context: Lipoprotein(a): Diagnosis, Prognosis, Controversies, and Emerging Therapies. J Am Coll Cardiol. 2017;69(6):692-711.
- Leibundgut G, Scipione C, Yin H, Schneider M, Boffa MB, Green S, et al. Determinants of binding of oxidized phospholipids on apolipoprotein (a) and lipoprotein (a). J Lipid Res. 2013;54(10):2815-30.
- Clarke R, Peden JF, Hopewell JC, Kyriakou T, Goel A, Heath SC, et al. Genetic variants associated with Lp(a) lipoprotein level and coronary disease. N Engl J Med. 2009;361(26):2518-28.
- Thanassoulis G, Campbell CY, Owens DS, Smith JG, Smith AV, Peloso GM, et al. Genetic associations with valvular calcification and aortic stenosis. N Engl J Med. 2013;368(6):503-12.
- Langsted A, Nordestgaard BG, Kamstrup PR. Elevated Lipoprotein(a) and Risk of Ischemic Stroke. J Am Coll Cardiol. 2019;74(1):54-66.
- Kamstrup PR, Nordestgaard BG. Elevated Lipoprotein(a) Levels, LPA Risk Genotypes, and Increased Risk of Heart Failure in the General Population. JACC Heart Fail. 2016;4(1):78-87.
- Mohammadi-Shemirani P, Chong M, Narula S, Perrot N, Conen D, Roberts JD, et al. Elevated Lipoprotein(a) and Risk of Atrial Fibrillation: An Observational and Mendelian Randomization Study. J Am Coll Cardiol. 2022;79(16):1579-90.
- Masson W, Lobo M, Barbagelata L, Molinero G, Bluro I, Nogueira JP. Elevated lipoprotein (a) levels and risk of peripheral artery disease outcomes: A systematic review. Vasc Med. 2022;27(4):385-91.
- Emerging Risk Factors C, Erqou S, Kaptoge S, Perry PL, Di Angelantonio E, Thompson A, et al. Lipoprotein(a) concentration and the risk of coronary heart disease, stroke, and nonvascular mortality. JAMA. 2009;302(4):412-23.
- Argraves KM, Kozarsky KF, Fallon JT, Harpel PC, Strickland DK. The atherogenic lipoprotein Lp(a) is internalized and degraded in a process mediated by the VLDL receptor. J Clin Invest. 1997;100(9):2170-81.
- Schnitzler JG, Hoogeveen RM, Ali L, Prange KHM, Waissi F, van Weeghel M, et al. Atherogenic Lipoprotein(a) Increases Vascular Glycolysis, Thereby Facilitating Inflammation and Leukocyte Extravasation. Circ Res. 2020;126(10):1346-59.
- van der Valk FM, Bekkering S, Kroon J, Yeang C, Van den Bossche J, van Buul JD, et al. Oxidized Phospholipids on Lipoprotein(a) Elicit Arterial Wall Inflammation and an Inflammatory Monocyte Response in Humans. Circulation. 2016;134(8):611-24.
- Greenberg ME, Sun M, Zhang R, Febbraio M, Silverstein R, Hazen SL. Oxidized phosphatidylserine-CD36 interactions play an essential role in macrophage-dependent phagocytosis of apoptotic cells. J Exp Med. 2006;203(12):2613-25.
- Marcovina SM, Albers JJ. Lipoprotein (a) measurements for clinical application. J Lipid Res. 2016;57(4):526-37.
- Capoulade R, Chan KL, Yeang C, Mathieu P, Bosse Y, Dumesnil JG, et al. Oxidized Phospholipids, Lipoprotein(a), and Progression of Calcific Aortic Valve Stenosis. J Am Coll Cardiol. 2015;66(11):1236-46.
- Zheng KH, Tsimikas S, Pawade T, Kroon J, Jenkins WSA, Doris MK, et al. Lipoprotein(a) and Oxidized Phospholipids Promote Valve Calcification in Patients With Aortic Stenosis. J Am Coll Cardiol. 2019;73(17):2150-62.
- Crawford DC, Peng Z, Cheng JF, Boffelli D, Ahearn M, Nguyen D, et al. LPA and PLG sequence variation and kringle IV-2 copy number in two populations. Hum Hered. 2008;66(4):199-209.
- Boerwinkle E, Leffert CC, Lin J, Lackner C, Chiesa G, Hobbs HH. Apolipoprotein(a) gene accounts for greater than 90% of the variation in plasma lipoprotein(a) concentrations. J Clin Invest. 1992;90(1):52-60.
- Nissen SE, Wolski K, Balog C, Swerdlow DI, Scrimgeour AC, Rambaran C, et al. Single Ascending Dose Study of a Short Interfering RNA Targeting Lipoprotein(a) Production in Individuals With Elevated Plasma Lipoprotein(a) Levels. JAMA. 2022;327(17):1679-87.
- Schwartz GG, Steg PG, Szarek M, Bhatt DL, Bittner VA, Diaz R, et al. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018;379(22):2097-107.
- Ference BA. The Potential Clinical Benefit of Lowering Lipoprotein(a). JAMA. 2022;327(17):1653-5.
- Coassin S, Schönherr S, Weissensteiner H, Erhart G, Forer L, Losso JL, et al. A comprehensive map of single-base polymorphisms in the hypervariable LPA kringle IV type 2 copy number variation region[S]. Journal of Lipid Research. 2019;60(1):186-99.
- Kronenberg F. Lipoprotein(a) measurement issues: Are we making a mountain out of a molehill? Atherosclerosis. 2022;349:123-35.
- Ruhaak LR, Cobbaert CM. Quantifying apolipoprotein(a) in the era of proteoforms and precision medicine. Clin Chim Acta. 2020;511:260-8.
- Diederiks NM, van der Burgt YEM, Ruhaak LR, Cobbaert CM. Developing an SI-traceable Lp(a) reference measurement system: a pilgrimage to selective and accurate apo(a) quantification. Crit Rev Clin Lab Sci. 2023;60(7):483-501.
- Cegla J, France M, Marcovina SM, Neely RDG. Lp(a): When and how to measure it. Ann Clin Biochem. 2021;58(1):16-21.
- Diederiks NM, van der Burgt YEM, Ruhaak LR, Cobbaert CM. Developing an SI-traceable Lp(a) reference measurement system: a pilgrimage to selective and accurate apo(a) quantification. Critical Reviews in Clinical Laboratory Sciences. 2023;60(7):483-501.