Auteurs: Dany Arsenault, PhD, Résident en biochimie clinique, Université de Montréal, Centre intégré universitaire de santé et de services sociaux (CIUSSS) du Saguenay–Lac-Saint-Jean et Dre Renée Guérin, biochimiste clinique, PhD CSPQ FCACB, Chef du service de biochimie médicale, Département de médecine de laboratoire, Centre intégré universitaire de santé et de services sociaux (CIUSSS) du Saguenay–Lac-Saint-Jean
Introduction
Le laboratoire est l’une des ressources les plus sollicitées par le système de santé. Elle représente environ 90% des données médicales objectives du dossier médical d’un patient1. À cette forte demande s’ajoute une croissance dans le développement des biomarqueurs utilisés en clinique. On estime que le nombre de tests disponibles pour la clinique aurait doublé au cours des 20 dernières années aux États-Unis, comptant plus de 3500 tests en 2022 et totalisant un marché de plus de 87 billions en 20212. Au Québec, le répertoire québécois des analyses de laboratoire de 2022-2023 comptait un peu plus de 1900 analyses pour l’ensemble des spécialités médicales3. Cette différence s’explique en partie par le fait que le Québec est un système public et que des autorisations ministérielles sont nécessaires pour offrir de nouvelles analyses, alors que le système américain est privé. Cet encadrement de la médecine de laboratoire au Québec vise à favoriser une saine gestion des ressources, en plus de protéger à la fois le système et le patient. Par exemple, l’ajout inutile d’un test augmentera considérablement la facture sociale alors que l’ajout d’un test dont les performances analytiques sont insuffisantes pour le contexte clinique visé représentera un risque pour le patient. On sait que les résultats de laboratoires influencent 60 à 70% des décisions cliniques1 et ce pourcentage peut atteindre de 72 à 88% dans certaines spécialités telles la cardiologie et l’oncologie4. En somme, une mauvaise gestion de la qualité clinique ou analytique des tests en utilisation est à fort coût social pour un système comme le nôtre, autant pour le patient (délais de traitements, des diagnostics et pronostics erronés) que pour les fonds publics.
Malgré une aussi grande importance du laboratoire dans les services de santé publics et les soins aux patients, ce dernier demeure un aspect de la clinique qui est mal connue du public et des professionnels du réseau5. Pour tenter de pallier cette méconnaissance, l’IFCC et le TF-OSLM ont récemment fait la promotion d’études visant à documenter le rôle du laboratoire dans les soins aux patients5. Ces deux organismes espèrent ainsi faire reconnaître l’importance de l’expertise de laboratoire en santé. Parmi les experts du laboratoire, le biochimiste clinique vient jouer un rôle central dans la gestion de la qualité et des risques au laboratoire. Le parcours de ce spécialiste comprend un doctorat de troisième cycle dans un domaine scientifique de pointe suivi d’une formation postdoctorale complète de deux ans alliant formation théorique et stages dans plusieurs milieux hospitaliers. Pour pratiquer au sein du réseau de santé québécois, les candidats doivent réussir un processus de certification auprès d’un comité d’experts en biochimie clinique, mandaté par l’ordre des chimistes du Québec (OCQ). Ce parcours nécessite au total entre 10 et 12 ans d’études universitaires, ce qui est l’équivalent de la formation requise pour les médecins spécialistes. L’expertise clinique et analytique acquise par le biochimiste clinique durant sa formation fait donc de lui un élément clé du réseau pour une bonne gestion et une bonne utilisation de l’ensemble des ressources du laboratoire. Sa formation lui permet, en outre, d’évaluer les risques analytiques et préanalytiques, d’encadrer les cliniciens dans l’interprétation des résultats du laboratoire ou de juger de la pertinence clinique d’une nouvelle analyse. Leur contribution a des répercussions directes sur la qualité de nos services de santé puisque des décisions médicales sont prises par les médecins sur la base des résultats de laboratoire.
Cet article vise à mieux faire comprendre le rôle du biochimiste clinique au sein de notre système de santé en présentant un exemple concret de l’ajout d’une nouvelle analyse de laboratoire à l’hôpital de Chicoutimi, la procalcitonine (PCT). Ce rôle est également partagé par d’autres experts de laboratoire ayant des fonctions similaires. La première partie décrira le processus de recherche afin de déterminer l’utilité et le potentiel clinique d’un biomarqueur. La seconde présentera l’évaluation analytique à faire en regard des besoins cliniques à satisfaire. Finalement, la dernière expliquera le processus d’implantation d’une analyse de laboratoire et les mesures de suivi nécessaires pour assurer sa qualité et sa pérennité dans le temps. Il est à noter que ce processus n’est pas exclusif puisque chaque évaluation doit être adaptée à la réalité clinique du milieu, les contextes cliniques ciblés et les impacts potentiels pour le patient. Chacune de ces parties sera présentée dans le cadre d’un article distinctif. Le présent article présente la prémice de ce processus, soit les recherches littéraires et scientifiques qui ont été réalisées par les biochimistes cliniques de Chicoutimi afin d’évaluer les connaissances actuelles et l’utilité clinique potentielle de la PCT.
Connaître les fonctions biologiques du biomarqueur, une étape essentielle
Comprendre le rôle d’un composé biologique aide à cibler le potentiel clinique de la molécule. En regard de la PCT, elle a été découverte en 1993 lors de travaux visant à identifier un biomarqueur de la résurgence du carcinome thyroïdien6. Au niveau des cellules C de la glande thyroïdienne, l’expression de la PCT par son gène CALC-I est stimulée par des molécules telles que les glucocorticoïdes, le glucagon ou la gastrine7. La protéine est ensuite métabolisée en calcitonine avant d’être sécrétée dans le sang (Fig. 1A). Dans les tissus extrathyroïdiens, la régulation de la PCT est sous le contrôle de régulateurs différents, comme ceux impliqués dans l’inflammation et les processus infectieux. Plus précisément, son expression augmente en contexte d’infection bactérienne (ex. TNF-α, IL-1β) et diminue lors d’une infection virale. Une autre particularité est que la PCT produite par ces cellules n’est pas convertie en calcitonine avant sa sécrétion, ce qui démontre que les cellules des tissus extrathyroïdiens ne possèdent pas la machinerie enzymatique pour compléter la maturation de la PCT en calcitonine7 (Fig. 1A). En contexte de sepsis bactérien, la majorité des tissus exprime la PCT, ce qui démontre le caractère ubiquitaire de son expression8 (Fig. 1B). Les études ont également démontré une relation entre la sévérité d’une infection bactérienne et la sécrétion sanguine de PCT. Cette relation était absente pour la CRP, un marqueur d’inflammation fréquemment utilisé dans les laboratoires cliniques9 (Fig. 1C). En ce qui concerne la cinétique d’apparition dans le sang en contexte de sepsis bactérien, la PCT est détectable dans le sang six heures après l’infection et est maximale après 24h10 (Fig. 1D). La demi-vie de la PCT serait de vingt-quatre heures10. En somme, ces évidences scientifiques proposent un rôle intéressant de la PCT dans (1) la détermination de la nature de l’infection (bactérien ou viral) et (2) la sévérité des infections bactériennes. Il faut cependant noter que la littérature rapporte une augmentation de la PCT dans certains contextes non infectieux (voir le tableau 1). Ces observations s’expliquent en partie par le fait que les mécanismes infectieux partagent des voies de signalisation communes à diverses situations cliniques. L’utilisation de la PCT comme biomarqueur pourrait impliquer une interprétation selon le contexte clinique.
Identifier les avantages du biomarqueur par rapport aux marqueurs actuels
La PCT est un marqueur à potentiel d’utilisation pour l’inflammation et les infections, deux conditions cliniques pour lesquelles des biomarqueurs sont déjà disponibles dans les laboratoires hospitaliers. Dans ce contexte, le biochimiste clinique doit remettre en perspective le biomarqueur à l’étude afin de bien cibler les gains potentiels à son utilisation. La révision de Reinhart compare la PCT avec les marqueurs « classiques » de l’inflammation et conclut que la PCT est particulièrement intéressante pour sa spécificité aux infections (Fig. 2)11. Sa capacité à discriminer certains types d’infections et sa relation avec la sévérité de l’infection sont des avantages potentiellement exploitables pour la clinique. La PCT n’est pas le seul biomarqueur rapporté par la littérature en lien avec les infections. Certaines revues récentes présentent une liste de nouveaux marqueurs biochimiques, comme certaines molécules du complément ou encore des micro-ARNs1213.
Plusieurs articles rapportent également un lien entre le sepsis et la largeur de la distribution des monocytes (monocyte distribution width ou MDW du nom anglais)141516. Ces marqueurs ont le potentiel de trouver leur place en médecine pour des contextes cliniques spécifiques. Cependant, nous n’avons pas le même recul que pour la PCT, qui a été largement étudiée.
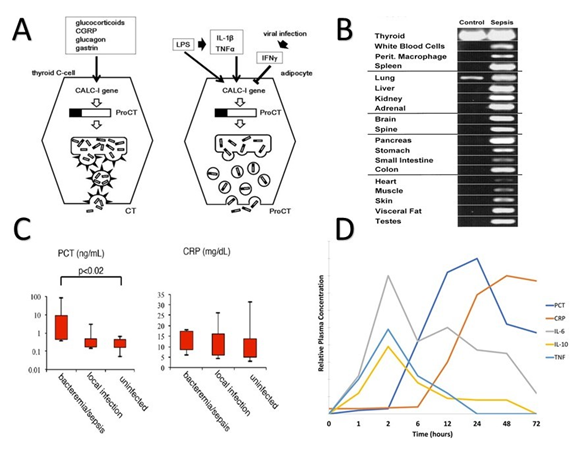
Figure 1 : Fonction biologique de la PCT. (A) Régulation de l’expression et de la transformation post-traductionnelle de la PCT dans les cellules C de la thyroïde et des cellules graisseuses (figure empruntée de Nakamura et al7). La PCT est le précurseur de la calcitonine au niveau des cellules C de la thyroïde et sa régulation est dépendante de certaines hormones. Dans les tissus graisseux, les marqueurs inflammatoires associés à une infection bactérienne semblent être les principaux régulateurs positifs de l’expression de la PCT, qui est ensuite sécrétée dans le sang sans conversion en calcitonine. Les marqueurs associés à une infection virale présentent une régulation négative de l’expression de la PCT (figure empruntée de Nakamura et al7). (B) L’expression de la PCT dans différents tissus en contexte sain et de sepsis (figure empruntée de Müller et al17). (C) La sécrétion de la PCT et de la CRP en fonction de la sévérité d’une infection bactérienne (figure empruntée à Ebihara et al9).
Tableau 1 : Listes des causes connues pour augmenter la PCT, autres que les infections bactériennes. Cette liste a été produite sur à partir de la littérature18,19,20,21,22,23,24,25,26 et n’est pas exclusive.

Identifier les contextes cliniques pertinents
En connaissant les rôles biologiques d’une molécule et ses mécanismes de régulation, il est possible d’identifier les intérêts potentiellement pertinents pour la clinique, ce qui guide les devis de recherche. En ce qui concerne la PCT, la révision du Dre Azzini est particulièrement intéressante et complète27. Elle documente les résultats de plus de quarante études dans lesquels la PCT présente des niveaux acceptables de sensibilité et de spécificité pour la clinique (souvent supérieurs à 80%). Cette révision permet de mettre en évidence les pathologies pour lesquelles la PCT est pertinente.
- Le sepsis (19 études),
- La méningite bactérienne (11 études) et
- Les infections des voies respiratoires basses / maladies pulmonaires chroniques (9 études).
Outre sa capacité à discriminer les infections bactériennes de celles qui sont virales, la relation entre la sévérité de l’infection et la quantité de PCT dans le sang est une caractéristique apportant une valeur clinique additionnelle par rapport aux marqueurs qui sont fréquemment utilisés dans nos milieux, comme la CRP. Cette particularité de la PCT permet en outre de guider la prescription aux antimicrobiens, une application clinique d’intérêt dans les publications. Dans un premier temps, la PCT permet de déterminer du moment opportun pour cesser le traitement aux antimicrobiens28. En réduisant la durée de prescription, on réduit le risque des patients de devenir porteur permanent d’une souche résistante plus difficile à traiter en cas de récidive, ce qui diminue par le fait même le risque de développer des souches résistantes dans les milieux de soins 293031. Le second avantage est d’identifier les prescriptions dont la couverture est inadéquate ou insuffisante pour l’infection en cours chez le patient. Dans cette situation, l’antibiothérapie n’empêchera pas la progression de l’infection, ce qui se traduira par une augmentation de la PCT malgré le traitement32. Cette information peut être cruciale pour le clinicien, surtout s’il s’agit d’un patient à risque, comme une personne avec des comorbidités ou immunodéprimée. Ces deux avantages de la PCT sont cliniquement pertinents pour un programme d’antibiogouvernance.
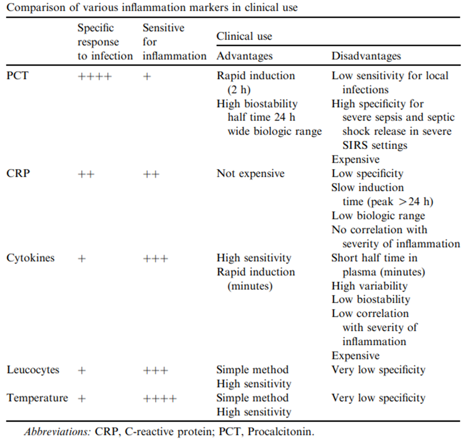
Figure 2 : Tableau comparatif des marqueurs inflammatoires utilisés en clinique. Figure empruntée de Reinhart et al11.
Les études cliniques supportent-elles l’utilisation du biomarqueur dans le contexte ciblé ?
Après avoir identifié la situation médicale pertinente (antibiogouvernance), il est pertinent de vérifier les essais cliniques qui ont été réalisés dans ce contexte. Les études identifiées lors de cette recherche sont présentées dans le tableau 2. Huit des dix études trouvées rapportaient une réduction de l’exposition aux antibiotiques sans effets adverses apparents en guidant la prescription d’antibiotique avec la PCT. En regardant les deux études qui n’ont pas observé de gain dans la durée de traitement, on constate que l’étude de ProACT rapportait une faible adhérence au protocole par les cliniciens et le taux de confirmation des infections bactériennes était faible, ce qui a pu biaiser les résultats de l’étude33. Pour sa part, l’étude BPCTréa ne rapportait pas de gain clinique à guider une antibiothérapie chez des patients atteints d’une maladie pulmonaire obstructive chronique (MPOC) qui ont été transférés aux soins intensifs suite à une crise sévère aigüe34. Cette étude présentait également certains biais potentiels. Elle ne décrivait pas en quoi consistait la prise en charge du groupe contrôle et rapportait dès le départ des taux de PCT plus élevés dans le groupe guidé par la PCT. En somme, nous constatons que la majorité des études cliniques trouvées dans la littérature supportait le rôle de la PCT dans la guidance d’une antibiothérapie. En regard du potentiel de la PCT pour guider l’initiation d’un traitement aux antimicrobiens, les études ne sont pas concluantes et certaines révisions sur le sujet suggèrent une certaine prudence dans ce contexte par rapport aux risques pour le patient35363738. On retrouve également un article qui s’oppose fermement à toute approche guidée par les biomarqueurs pour initier un traitement en cas de sepsis39. De futures études semblent nécessaires pour conclure sur l’utilisation de la PCT dans ce contexte.
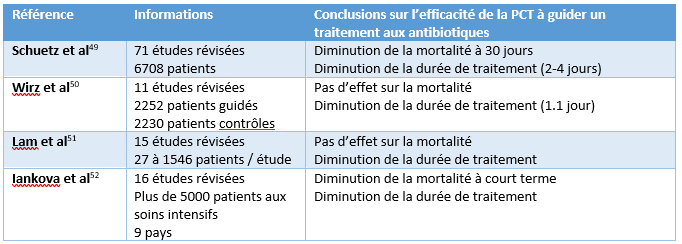
Lorsque les études cliniques ne sont pas totalement unanimes, comme l’utilisation de la PCT pour guider la cessation d’un traitement antimicrobien, il peut être intéressant de se tourner vers les méta-analyses. Cette approche statistique combine les résultats de plusieurs études indépendantes portant sur une question de recherche similaire, afin d’obtenir une estimation globale plus précise de l’effet d’intérêt40. En d’autres termes, la méta-analyse est une synthèse statistique puissante des résultats provenant de plusieurs études, ce qui peut améliorer la précision des estimations et permettre des conclusions plus robustes. Notre recherche dans la littérature nous a permis d’identifier cinq méta-analyses portant sur l’efficacité de la PCT pour guider une antibiothérapie (Tableau 3). Les cinq études concluent que de guider une antibiothérapie avec la PCT réduit la durée de traitement sans risque pour le patient. De plus, deux études sur cinq rapportent une baisse de la mortalité en guidant une antibiothérapie avec la PCT. Ces synthèses statistiques supportent toutes l’utilisation de la PCT dans un programme d’antibiogouvernance.
Tableau 2 : Révision de la littérature sur l’efficacité de la PCT pour guider une antibiothérapie.
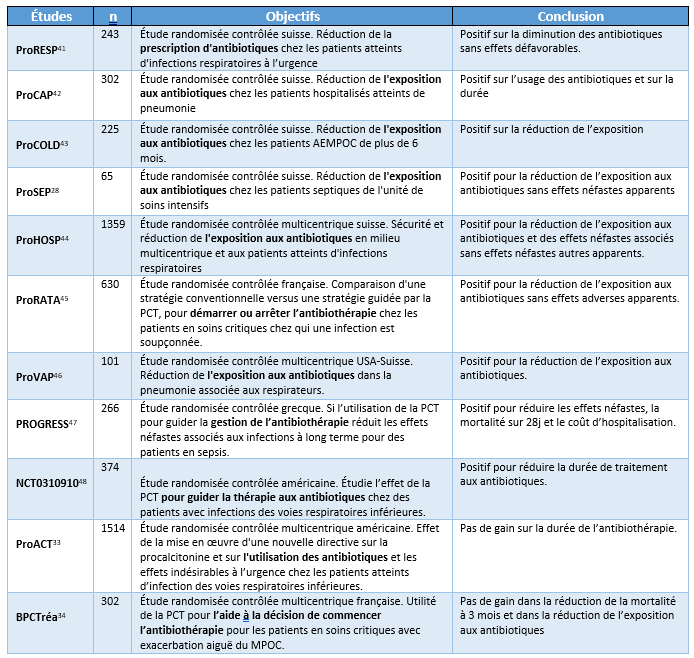
Tableau 3 : Résumé des conclusions des méta-analyses trouvées dans la littérature.
Les lignes directrices suggèrent-elles l’utilisation du biomarqueur ?
Les diverses spécialités médicales sont une autre source de référence vers laquelle le biochimiste clinique doit se tourner pour se faire une opinion claire. Ces dernières représentent l’opinion de différents experts médicaux et permettent de cibler les spécialités qui présentent un intérêt pour le biomarqueur. De plus, en identifiant le contexte clinique pour lequel les spécialistes recommandent l’utilisation du marqueur, le biochimiste pourra mieux cerner le service qu’il devra mettre en place s’il intègre cette analyse à son menu laboratoire. Par exemple, un marqueur dédié aux urgences ou pouvant impacter les décisions cliniques du moment devrait être offert en continu et dans des délais raisonnables. Au moment de l’évaluation de la PCT par les biochimistes, trois lignes directrices se positionnaient sur l’utilisation de la PCT. L’IDSA (infectious diseases Society of America, du nom anglais) recommandait la PCT pour déterminer de la cessation d’un antibiotique, mais ne l’a recommandait pas pour déterminer de l’initiation d’un traitement chez les patients atteints d’une pneumonie nocosomiale53. Elle recommande également l’utilisation de la PCT comme guide chez les patients en soins intensifs avec suspicion d’infection54. Finalement, l’ « americain Thoracic Society » recommande la PCT pour guider la cessation d’un traitement aux antibiotiques, mais pas pour initier un traitement55. Ces recommandations viennent supporter l’utilisation de la PCT dans un contexte d’antibiogouvernance et démontrent l’intérêt de certaines associations / société pour le biomarqueur. Cependant, les lignes directrices de ces trois ressources ne recommandent pas l’utilisation de la PCT pour guider la décision d’initier ou non un traitement antimicrobien. En suivant l’évolution des lignes directrices des différentes spécialités médicales, le biochimiste peut anticiper les demandes à venir pour certaines analyses.
L’intérêt des organismes d’autorité est-il favorable à l’utilisation du biomarqueur dans le contexte ciblé ?
Lors de l’analyse de la pertinence clinique d’un biomarqueur, le clinicien doit toujours se référer aux intérêts des organismes d’autorité et aux recommandations faites par ces derniers. La lutte à la résistance aux antimicrobiens est un sujet d’intérêt. Dans une révision sur le sujet, Dr O’Neill estimait que 700 000 personnes par année décédaient des suites d’une infection résistante aux antimicrobiens et il évaluait que ce nombre pourrait atteindre
10 millions en 205056. En ce sens, l’Organisation Mondiale de la Santé (OMS) a émis en 2015 un plan d’action mondial pour combattre la résistance aux antimicrobiens57. Le Canada a suivi en 2017 avec son plan d’action pancanadien pour combattre la résistance aux antimicrobiens58. Les objectifs définis dans ce plan d’action sont de lutter contre la résistance aux antimicrobiens et optimiser l’utilisation des antimicrobiens. Les principaux secteurs visés sont la médecine humaine / vétérinaire et le secteur agricole. Le cadre du plan d’action se fonde sur 4 éléments, soit (1) la surveillance, (2) la prévention et le contrôle des infections, (3) l’antibiogouvernance et (4) la recherche / innovation. L’antibiogouvernance est défini comme « des programmes qui mettent l’accent sur l’éducation, la sensibilisation et la supervision des antimicrobiens afin de :
- réduire la prescription, la distribution et l’utilisation inappropriée d’antimicrobiens chez les humains et les animaux,
- promouvoir d’autres moyens de favoriser la santé et de prévenir les infections. »
Les évidences scientifiques précédemment décrites démontrent que la PCT pourrait jouer un rôle important pour réduire la prescription, la distribution et l’utilisation inappropriées d’antimicrobiens. Le marqueur pourrait permettre de discriminer entre une infection bactérienne et virale, ce qui pourrait éviter de prescrire des antimicrobiens en contexte d’infection virale. La corrélation entre la PCT et la sévérité de l’infection en fait un indicateur intéressant pour déterminer de la cessation d’un antimicrobien (réduire la prescription). De plus, la PCT peut informer de l’inefficacité d’un traitement aux antimicrobiens, permettant ainsi au clinicien de modifier plus rapidement sa prescription (réduisant par conséquent l’exposition finale aux antimicrobiens). En somme, la PCT est un biomarqueur dont l’utilité clinique pourrait répondre aux volontés des organismes d’autorité.
L’interprétation finale de la recherche documentaire, un outil de décision essentiel pour l’équipe multidisciplinaire
Après sa révision, le biochimiste clinique doit prendre position par rapport au potentiel du biomarqueur pour la clinique du milieu où il pratique. Son travail de recherche servira de base aux discussions qui devrait suivre avec l’équipe clinique spécialisée (ex. microbiologie), l’équipe multidisciplinaire décisionnelle du laboratoire et les gestionnaires afin de remettre en contexte le biomarqueur pour que des décisions plus éclairées soient prises. Ceci sous-entend de faire une mise à jour des utilités cliniques rapportées dans la littérature et de préciser les limites / risques pour la clinique. Il faudra également remettre en perspective la faisabilité d’une implémentation de l’analyse, incluant une révision des performances analytiques attendues selon les différentes options et les impacts potentiels dans la gestion du laboratoire (coûts, besoin en formation et en personnel). Cette remise en contexte dans le milieu pratique par un expert est essentielle puisque les différentes ressources consultées ne tiennent pas compte des réalités de chaque milieu, des équipements en place, de la pratique des cliniciens du milieu et des alternatives présentes dans le laboratoire.
Dans la présente situation, l’équipe du projet de l’hôpital de Chicoutimi a cru en la pertinence de la PCT. La modulation biologique de la PCT dans certains contextes infectieux est très bien documentée, les contextes cliniques confirmés sont le sepsis, la méningite bactérienne et les infections des voies respiratoires basses, le marqueur cadre parfaitement avec les intérêts des organismes d’autorité (OMS et Santé Canada) pour un programme d’antibiogouvernance, la littérature supporte l’utilisation de ce marqueur dans ce contexte et certaines lignes directrices recommandent l’utilisation de la PCT pour guider la cessation des antibiotiques. Les évidences de la littérature démontrent que la spécificité de la PCT pour les infections est supérieure à celles des autres marqueurs inflammatoires, ce qui apporte un gain clinique potentiel pour le laboratoire. L’analyse est disponible en clinique et certaines trousses de détection ont été autorisées par Santé Canada et cadrent dans les équipements en place. Cependant, les contextes d’utilisation doivent être clairement définis puisque la sensibilité de la PCT se limite à certains types d’infection et son utilisation pour guider l’initiation d’un traitement antimicrobien n’est pas supportée dans la littérature et les lignes directrices. Les recommandations d’utilisation devront également tenir compte des autres causes non infectieuses pouvant augmenter la PCT afin d’éviter de fausses interprétations médicales.
Il est également important de définir la nature de l’offre de service visée. La nature du service offert est en lien direct avec les applications cliniques possibles du biomarqueur. Une offre en continu de la PCT dans les laboratoires d’une région permettra une utilisation décisionnelle à temps de réponse court de ce biomarqueur comme l’initiation de l’antibiothérapie alors qu’une offre centralisée (centre serveur seulement par exemple) demandera une utilisation à temps-réponse plus long tel que le suivi de l’efficacité de l’antibiothérapie. Ces deux offres distinctes de service ont des coûts financiers et des implications fonctionnelles différents et tous ces facteurs doivent être pris en compte, en relation avec les gains cliniques, dans la décision finale. Dans la présente situation, il a été décidé de poursuivre l’analyse du dossier pour implémenter une offre de service en continu au centre serveur seulement. L’objectif actuel est d’offrir la PCT pour une application clinique très bien documentée, soit le suivi de l’antibiothérapie. Il est à noter que l’offre de service pourra être réévaluée au besoin.
Conclusion
Cette première partie donne un aperçu du travail de recherche que doit réaliser un biochimiste clinique afin d’évaluer la pertinence clinique d’un biomarqueur et la faisabilité de son implantation potentielle dans le laboratoire. Cette évaluation doit être personnalisée pour chaque biomarqueur et révisée si l’objectif clinique change. Cette première étape implique donc de faire un travail de recherche pour connaître la littérature en regard du biomarqueur, confirmer ou invalider l’utilisation clinique visée et identifier les risques potentiels pour le patient. Ce travail de recherche doit être ensuite présenté à tous les acteurs du réseau qui seront concernés. Cette étape est essentielle pour assurer une bonne cohésion de nos laboratoires, de nos ressources personnelles et pour limiter les risques pour le patient. Le laboratoire est l’une des ressources les plus sollicitées par le système de santé, l’implémentation inutile d’une analyse de laboratoire conduira à une augmentation considérable de la facture sociale, sans bénéfice pour le patient. L’ajout d’une analyse insuffisamment maîtrisée provoquera des lacunes dans l’interprétation du résultat. Puisque les résultats de laboratoires influencent 60 à 70% des décisions cliniques1, chaque interprétation erronée impactera négativement la qualité des soins prodigués aux patients. Dans le présent exemple, il a été décidé que la PCT avait une pertinence clinique pour un programme d’antibiogouvernance.
Références
- Hallworth MJ. The “70% claim”: what is the evidence base? Ann Clin Biochem. 2011;48(Pt 6):487-488. doi:10.1258/ACB.2011.011177
- Research K. Global In-Vitro Diagnostics (IVD) Market to Garner a Revenue of USD 135167.7 Million by 2031 and Touch a CAGR of 4.6% During 2022-2031; Market to Grow on Account of Growing Prevalence of Chronic and Infectious Diseases. GLOBE NEWSWIRE. https://www.globenewswire.com/en/news-release/2022/05/16/2443598/0/en/Global-In-Vitro-Diagnostics-IVD-Market-to-Garner-a-Revenue-of-USD-135167-7-Million-by-2031-and-Touch-a-CAGR-of-4-6-During-2022-2031-Market-to-Grow-on-Account-of-Growing-Prevalence-.html
- ministère de la Santé et des Services sociaux. Répertoire Québécois et Système de Mesure Des Procédures de Biologie Médicale – Édition 2021-2022. https://publications.msss.gouv.qc.ca/msss/document-002602/
- Rohr UP, Binder C, Dieterle T, et al. The Value of In Vitro Diagnostic Testing in Medical Practice: A Status Report. PLoS One. 2016;11(3):e0149856. doi:10.1371/JOURNAL.PONE.0149856
- Olver P, Bohn MK, Adeli K. Central role of laboratory medicine in public health and patient care. Clin Chem Lab Med. 2023;61(4):666-673. doi:10.1515/CCLM-2022-1075/MACHINEREADABLECITATION/RIS
- Chourrout P. La procalcitonine : de la découverte à l’utilisation clinique. Médecine Nucléaire. 2008;32(3):132-137. doi:10.1016/J.MEDNUC.2007.01.008
- Nakamura M, Kono R, Nomura S, Utsunomiya H. Procalcitonin: Mysterious Protein in Sepsis. Basic Clin Med. Published online 2013.
- Müller B, White JC, Nylén ES, Snider RH, Becker KL, Habener JF. Ubiquitous expression of the calcitonin-I gene in multiple tissues in response to sepsis. J Clin Endocrinol Metab. 2001;86(1):396-404. doi:10.1210/jc.86.1.396
- Ebihara Y, Kobayashi K, Ishida A, et al. Diagnostic performance of procalcitonin, presepsin, and C-reactive protein in patients with hematological malignancies. J Clin Lab Anal. 2017;31(6). doi:10.1002/JCLA.22147
- Chambliss AB, Patel K, Colón-Franco JM, et al. AACC Guidance Document on the Clinical Use of Procalcitonin. J Appl Lab Med. 2023;8(3):598-634. doi:10.1093/JALM/JFAD007
- Reinhart K, Meisner M, Brunkhorst FM. Markers for sepsis diagnosis: what is useful? Crit Care Clin. 2006;22(3):503-519. doi:10.1016/J.CCC.2006.03.003
- Barichello T, Generoso JS, Singer M, Dal-Pizzol F. Biomarkers for sepsis: more than just fever and leukocytosis—a narrative review. Crit Care. 2022;26(1):1-31. doi:10.1186/S13054-021-03862-5/TABLES/1
- Kim MH, Choi JH. An Update on Sepsis Biomarkers. Infect Chemother. 2020;52(1):1. doi:10.3947/IC.2020.52.1.1
- Jo SJ, Kim SW, Choi JH, Choi SP, Lee J, Lim J. Monocyte distribution width (MDW) as a useful indicator for early screening of sepsis and discriminating false positive blood cultures. PLoS One. 2022;17(12):e0279374. doi:10.1371/JOURNAL.PONE.0279374
- Crouser ED, Parrillo JE, Seymour CW, et al. Monocyte Distribution Width: A Novel Indicator of Sepsis-2 and Sepsis-3 in High-Risk Emergency Department Patients*. Crit Care Med. 2019;47(8):1018. doi:10.1097/CCM.0000000000003799
- Polilli E, Frattari A, Esposito JE, et al. Monocyte distribution width (MDW) as a new tool for the prediction of sepsis in critically ill patients: a preliminary investigation in an intensive care unit. BMC Emerg Med. 2021;21(1):1-11. doi:10.1186/S12873-021-00521-4/TABLES/5
- Schuetz P, Wirz Y, Sager R, et al. Effect of procalcitonin-guided antibiotic treatment on mortality in acute respiratory infections: a patient level meta-analysis. Lancet Infect Dis. 2018;18(1):95-107. doi:10.1016/S1473-3099(17)30592-3
- Becker KL, Nylén ES, White JC, Müller B, Snider RH. Procalcitonin and the Calcitonin Gene Family of Peptides in Inflammation, Infection, and Sepsis: A Journey from Calcitonin Back to Its Precursors. J Clin Endocrinol Metab. 2004;89(4):1512-1525. doi:10.1210/JC.2002-021444
- Huang HL, Nie X, Cai B, et al. Procalcitonin Levels Predict Acute Kidney Injury and Prognosis in Acute Pancreatitis: A Prospective Study. PLoS One. 2013;8(12). doi:10.1371/JOURNAL.PONE.0082250
- Hamade B, Huang DT. Procalcitonin: Where Are We Now? Crit Care Clin. 2020;36(1):23. doi:10.1016/J.CCC.2019.08.003
- Dale L. The Use of Procalcitonin in the Diagnosis of Acute Appendicitis: A Systematic Review. Cureus. 2022;14(10). doi:10.7759/CUREUS.30292
- Barantsevich N, Barantsevich E. Diagnosis and Treatment of Invasive Candidiasis. Antibiot (Basel, Switzerland). 2022;11(6). doi:10.3390/ANTIBIOTICS11060718
- Katte JC, Penanje K, Agoons BB, et al. Procalcitonin levels in children affected by severe malaria compared to those with uncomplicated malaria in the absence of bacterial infection: a cross-sectional study. Trop Dis Travel Med vaccines. 2022;8(1). doi:10.1186/S40794-022-00163-9
- Hu R, Han C, Pei S, Yin M, Chen X. Procalcitonin levels in COVID-19 patients. Int J Antimicrob Agents. 2020;56(2). doi:10.1016/J.IJANTIMICAG.2020.106051
- Sugihara T, Koda M, Okamoto T, et al. Serum Procalcitonin in Patients with Acute Liver Failure. Yonago Acta Med. 2017;60(1):40. Accessed June 6, 2023. /pmc/articles/PMC5355843/
- Parli SE, Trivedi G, Woodworth A, Chang PK. Procalcitonin: Usefulness in Acute Care Surgery and Trauma. Surg Infect (Larchmt). 2018;19(2):131-136. doi:10.1089/SUR.2017.307
- Azzini AM, Dorizzi RM, Sette P, et al. A 2020 review on the role of procalcitonin in different clinical settings: an update conducted with the tools of the Evidence Based Laboratory Medicine. Ann Transl Med. 2020;8(9):610-610. doi:10.21037/atm-20-1855
- Nobre V, Harbarth S, Graf JD, Rohner P, Pugin J. Use of procalcitonin to shorten antibiotic treatment duration in septic patients: A randomized trial. Am J Respir Crit Care Med. 2008;177(5):498-505. doi:10.1164/rccm.200708-1238OC
- Tacconelli E, Górska A, De Angelis G, et al. Estimating the association between antibiotic exposure and colonization with extended-spectrum β-lactamase-producing Gram-negative bacteria using machine learning methods: a multicentre, prospective cohort study. Clin Microbiol Infect. 2020;26(1):87-94. doi:10.1016/J.CMI.2019.05.013
- Chinemerem Nwobodo D, Ugwu MC, Oliseloke Anie C, et al. Antibiotic resistance: The challenges and some emerging strategies for tackling a global menace. J Clin Lab Anal. 2022;36(9). doi:10.1002/JCLA.24655
- Shah T, Baloch Z, Shah Z, Cui X, Xia X. The Intestinal Microbiota: Impacts of Antibiotics Therapy, Colonization Resistance, and Diseases. Int J Mol Sci. 2021;22(12). doi:10.3390/IJMS22126597
- Aulin LBS, de Lange DW, Saleh MAA, van der Graaf PH, Völler S, van Hasselt JGC. Biomarker-Guided Individualization of Antibiotic Therapy. Clin Pharmacol Ther. 2021;110(2):346-360. doi:10.1002/CPT.2194
- Huang DT, Yealy DM, Filbin MR, et al. Procalcitonin-Guided Use of Antibiotics for Lower Respiratory Tract Infection. N Engl J Med. 2018;379(3):236-249. doi:10.1056/nejmoa1802670
- Daubin C, Valette X, Thiollière F, et al. Procalcitonin algorithm to guide initial antibiotic therapy in acute exacerbations of COPD admitted to the ICU: a randomized multicenter study. Intensive Care Med. 2018;44(4):428-437. doi:10.1007/s00134-018-5141-9
- Jensen JU, Hein L, Lundgren B, et al. Procalcitonin-guided interventions against infections to increase early appropriate antibiotics and improve survival in the intensive care unit: a randomized trial. Crit Care Med. 2011;39(9):2048-2058. doi:10.1097/CCM.0B013E31821E8791
- Layios N, Lambermont B, Canivet JL, et al. Procalcitonin usefulness for the initiation of antibiotic treatment in intensive care unit patients. Crit Care Med. 2012;40(8):2304-2309. doi:10.1097/CCM.0B013E318251517A
- Niederman MS, Baron RM, Bouadma L, et al. Initial antimicrobial management of sepsis. Crit Care. 2021;25(1). doi:10.1186/S13054-021-03736-W
- Velissaris D, Zareifopoulos N, Lagadinou M, et al. Procalcitonin and sepsis in the Emergency Department: an update. Eur Rev Med Pharmacol Sci. 2021;25(1):466-479. doi:10.26355/EURREV_202101_24416
- Schlattmann P, Brunkhorst FM. Procalcitonin as a diagnostic marker for sepsis. Lancet Infect Dis. 2014;14(3):189. doi:10.1016/S1473-3099(13)70325-6
- Murad MH, Asi N, Alsawas M, Alahdab F. New evidence pyramid. Evid Based Med. 2016;21(4):125-127. doi:10.1136/EBMED-2016-110401
- Christ-Crain M, Jaccard-Stolz D, Bingisser R, et al. Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower respiratory tract infections: Cluster-randomised, single-blinded intervention trial. Lancet. 2004;363(9409):600-607. doi:10.1016/S0140-6736(04)15591-8
- Christ-Crain M, Stolz D, Bingisser R, et al. Procalcitonin guidance of antibiotic therapy in community-acquired pneumonia: A randomized trial. Am J Respir Crit Care Med. 2006;174(1):84-93. doi:10.1164/rccm.200512-1922OC
- Stolz D, Christ-Grain M, Bingisser R, et al. Antibiotic treatment of exacerbations of COPD: A randomized, controlled trial comparing procalcitonin-guidance with standard therapy. Chest. 2007;131(1):9-19. doi:10.1378/chest.06-1500
- Schuetz P, Christ-Crain M, Thomann R, et al. Effect of procalcitonin-based guidelines vs standard guidelines on antibiotic use in lower respiratory tract infections: The ProHOSP randomized controlled trial. Jama. 2009;302(10):1059-1066. doi:10.1001/jama.2009.1297
- Bouadma L, Luyt CE, Tubach F, et al. Use of procalcitonin to reduce patients’ exposure to antibiotics in intensive care units (PRORATA trial): a multicentre randomised controlled trial. Lancet. 2010;375(9713):463-474. doi:10.1016/S0140-6736(09)61879-1
- Stolz D, Smyrnios N, Eggimann P, et al. Procalcitonin for reduced antibiotic exposure in ventilator-associated pneumonia: a randomised study. Eur Respir J. 2009;34(6):1364-1375. doi:10.1183/09031936.00053209
- Kyriazopoulou E, Liaskou-Antoniou L, Adamis G, et al. Procalcitonin to reduce long-term infection-associated adverse events in sepsis a randomized trial. Am J Respir Crit Care Med. 2021;203(2):202-210. doi:10.1164/rccm.202004-1201OC
- Townsend J, Adams V, Galiatsatos P, et al. Procalcitonin-guided antibiotic therapy reduces antibiotic use for lower respiratory tract infections in a United States medical center: Results of a clinical trial. Open Forum Infect Dis. 2018;5(12). doi:10.1093/ofid/ofy327
- Schuetz P, Wirz Y, Sager R, et al. Effect of procalcitonin-guided antibiotic treatment on mortality in acute respiratory infections: a patient level meta-analysis. Lancet Infect Dis. 2018;18(1):95-107. doi:10.1016/S1473-3099(17)30592-3
- Wirz Y, Meier MA, Bouadma L, et al. Effect of procalcitonin-guided antibiotic treatment on clinical outcomes in intensive care unit patients with infection and sepsis patients: a patient-level meta-analysis of randomized trials. Crit Care. 2018;22(1). doi:10.1186/S13054-018-2125-7
- Lam SW, Bauer SR, Fowler R, Duggal A. Systematic review and meta-analysis of procalcitonin-guidance versus usual care for antimicrobial management in critically ill patients: Focus on subgroups based on antibiotic initiation, cessation, or mixed strategies. Crit Care Med. 2018;46(5):684-690. doi:10.1097/CCM.0000000000002953
- Iankova I, Thompson-Leduc P, Kirson NY, et al. Efficacy and safety of procalcitonin guidance in patients with suspected or confirmed sepsis: A systematic review and meta-analysis. Crit Care Med. 2018;46(5):691-698. doi:10.1097/CCM.0000000000002928
- Kalil AC, Metersky ML, Klompas M, et al. Management of Adults With Hospital-acquired and Ventilator-associatedPneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of Americaand the American Thoracic Society. Clin Infect Dis An Off Publ Infect Dis Soc Am. 2016;63(5):e61. doi:10.1093/CID/CIW353
- Barlam TF, Cosgrove SE, Abbo LM, et al. Implementing an Antibiotic Stewardship Program: Guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America. Clin Infect Dis. 2016;62(10):e51-e77. doi:10.1093/CID/CIW118
- Metlay JP, Waterer GW, Long AC, et al. Diagnosis and Treatment of Adults with Community-acquired Pneumonia. An Official Clinical Practice Guideline of the American Thoracic Society and Infectious Diseases Society of America. https://doi.org/101164/rccm201908-1581ST. 2019;200(7):E45-E67. doi:10.1164/RCCM.201908-1581ST
- Neill JO’. Antimicrobial Resistance: Tackling a crisis for the health and wealth of nations The Review on Antimicrobial Resistance Chaired. 2014;(December).
- OMS. Plan d ’ action mondial pour combattre la résistance aux antimicrobiens. Bibliothèque de l’OMS. Published online 2015:32. https://apps.who.int/iris/bitstream/handle/10665/249548/9789242509762-fre.pdf;jsessionid=581A9E1BA143898B2A2A2D3FB3F0D95D?sequence=1
- Canada S. Lutter Contre La Résistance Aux Antimicrobiens et Optimiser Leur Utilisation : Un Cadre d’action.; 2017. https://www.canada.ca/content/dam/hc-sc/documents/services/publications/drugs-health-products/tackling-antimicrobial-resistance-use-pan-canadian-framework-action/lutter-contre-resistance-antimicrobiens-optimiser-utilisation-cadre-action-pancanadien.pdf

